研研说 | 成功召开研究中心启动会的秘诀
发布时间:2024-09-30 16:21分类: 无 浏览:391评论:0

我们常说“好的开始是成功的一半”。在临床试验中,研究中心启动意味着一个项目正式开始接受临床检验,需要准备好即刻进行受试者招募入组。同时,启动会的召开也有别于启动阶段(SSU阶段),意味着更多研究中心的研究者开始参与到该研究中。如何能在一场简短、高效的启动会上将我们的项目”广而告之“,让各研究中心的研究者能全面了解此项目的关键点就显得至关重要。
那么,如何成功举办一场启动会,我们将从如下这些维度解析成功召开启动会的秘诀,助力大家:
通常来说,在开展启动会准备工作前,我们首先需要明确启动会的目的,包括确保研究者熟悉试验方案、GCP相关要求;确保中心数据记录收集、操作流程等均符合试验方案和法律法规相关要求。
这些都需要我们在前序和SSU同事的交接过程中,在启动前充分了解项目要求,了解中心流程。为此,在研究中心启动访视前,通常我们会遵照SOP要求清晰了解如下内容:
结合项目的一些特殊要求参考项目层面的SIV readiness checklist进行准备。
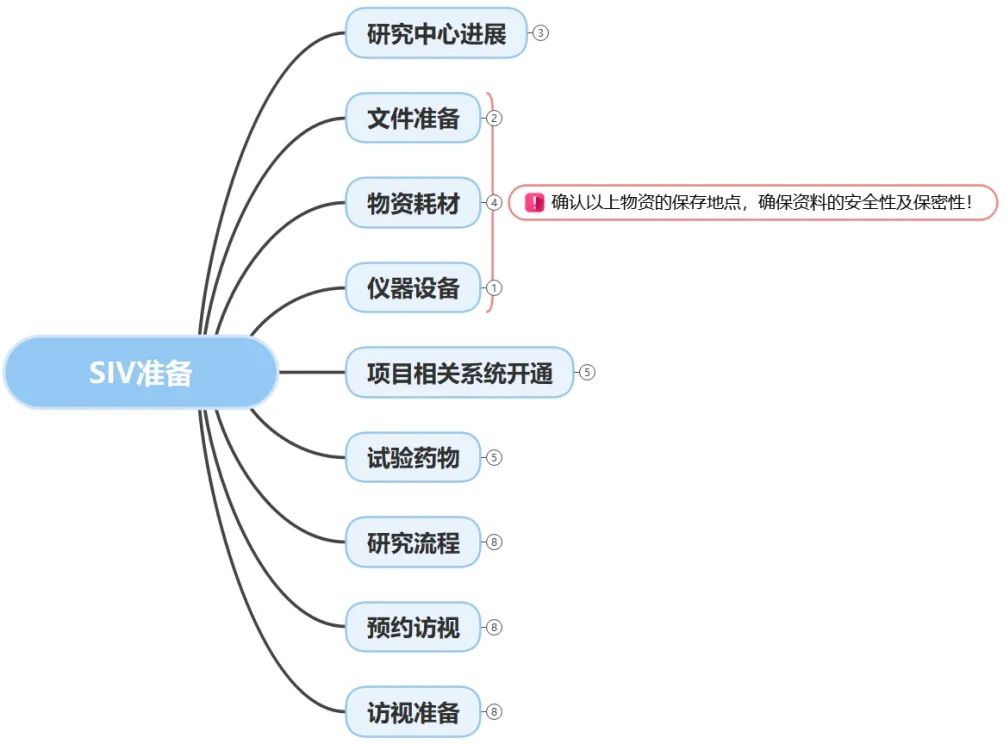
特别注意在启动会前确认明晰研究团队人员、机构、其他辅助科室之间的人物关系及特殊流程,并确保衔接沟通顺畅。
举例来说,肿瘤项目会涉及到影像科排期,刻盘等,那么我们就需要提前和影像科老师了解研究中心各类影像检查需要提前多久进行预约,结果多久获得,是否有绿色通道等。如果有中心影像的需求,影像科对于影像刻盘外送、上传系统是否有特殊要求,应该找哪位老师对接此事;
如果有肿瘤组织样本需要外送,那么我们需要提前了解研究中心病理科对于已有样本染色,白片寄送是否有相应的流程,是否有数量要求。如果是新鲜样本,处理的周期如何,是否能支持蜡块寄送等等中心实验室的要求,本中心是否能满足。
研究中心所在科室有时会分成多个治疗组,我们计划授权的sub-I所属的治疗组的情况,计划授权进入项目的研究者也需要提前了解,是否能对口我们项目需要的适应症人群,潜在患者的数量是否和前期调研一致等内容都属于启动前调研的范畴。
确保受试者筛选前相关工作均已准备完成,受试者筛选通道打开(最重要,特别关注)。
个别研究中心启动前可能会要求质控,或者类似启动放行的文件等需要CRA在启动访视前探查;
对于协助科室而言合同签署完成和正式接受病例筛选检查之间,有时会有诸如免费检查流程等内容需要启动CRA在启动访视前探查并准备完成。
准备就绪,那么正式启动会当天,将真正检验启动前的各项准备是否充分。那么启动会当天,有哪些关键点和细节需要关注?
启动会前准备的各项细节:
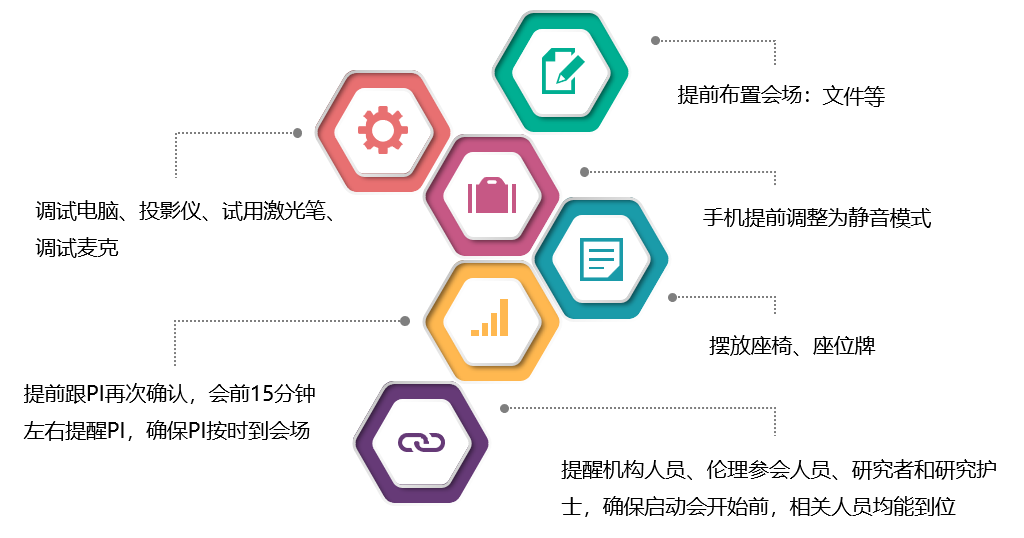
启动会过程中的注意事项:
1. 声音洪亮、注意语速、把控时间
启动会中中针对全体研究者的培训时间有限,有些启动的整体培训时间因各种意外而被打断,时间比预期更短,所以需要在启动会的培训时突出重点,建议重点顺序是:受试者入排标准为第一要点;其次是受试者安全性和项目特殊流程要求;其他内容如果因时间关系可以在大范围启动会议结束后,单独针对授权内容通过小范围给相应授权的执行人进行培训,充分保证培训的完整性,有的放矢的进行;
2. 委婉、真诚应对未能即刻回应的问题
启动会中所提出的未能即刻回应的问题,建议大家委婉、真诚应对。如:感谢您的提问,对项目执行非常有帮助,我会跟项目组确认后,最晚xxx给您明确答复......(Tips: 最终将确认后的答案切实的反馈至相应研究者, 既体现CRA的专业,也给予CRA更多和研究者沟通并推进受试者筛选的机会);
3. 切忌不懂装懂,答非所问
文件收集的注意事项:
启动会当天会产生大量的文件,如启动签到表、培训表和授权表等这一类时效性较强的文件。对此,我们非常建议大家在启动会前与CRC明确分工、启动会培训期间完成签署并及时监查文件是否合格,减少启动会后在文件收集工作中的工时花费。
此外,对于文件合规性确认,我们需要结合质量五要素(人、机、料、法、环),串联时间+空间,确认所有的记录是否满足ALCOA CCEA原则。
ALCOA+CCEA原则:
包含Attributable(可归性)、Legible(清晰易读)、Contemporaneous(同步)、Original(原始性)、Accurate(准确性)五大原则。
后又出对ALCOA原则进行补充,又提出了CCEA原则,也称为ALCOA+ 原则,即Complete(全面性)、Consistent(一致性)、Enduring(持久性)、Available(可用性)。
不同授权角色的培训需要更具针对性:
1. 研究者
知情过程、患者获益和风险、知情同意书签署要点、确保患者充分知情、入排标准的理解和受试者筛选入组路径/影响因素(这部分尤为重要,会影响到后续的受试者筛选通道是否能正常开展)、试验流程的把握、病程书写要点、CRF(eCRF)填写、质疑解答、SAE上报等。
2. 药物管理员
药物的接收保存、分发、保存、回收,药物相关表格的填写,建议可以当面交流确认每个环节的流程以及对应原始数据的记录要求等,最好能按照项目组要求填写一份模板供老师参考。
3. 研究护士
血样采集(建议当面交流确认样本采集及处理的分工,并和对应人员面对面确认好每个环节的流程以及对应原始数据的记录要求等,最好能填写一份模板供老师参考)、生命体征检测、药物的用法用量、药物分发、使用、配制等。
4. 影像科医生老师
随访周期、影像采集要求,影像评估要求等。(需要注意的是肿瘤评估标准的培训和确认,有很多影像科老师虽然是专职的,但项目上可能存在与临床实践不一样的评估标准,需要在后续的实践问题中不断地培训、强调与巩固)。
5. CRC
CRC作为中心主要的协助者,需要注意的是CRC所支持和协助的各环节内容是否合规且是否被授权。
在整个培训过程中,流程梳理及梳理后如何执行是关键
这包括但不仅限于:受试者筛选流程、生命体征采集流程、药物使用流程、样本采集处理流程等。我们也同样建议大家遵照质量五要素(人、机、料、法、环)进行梳理及培训。我们以受试者筛选流程为例:
人
推荐受试者的研究者有哪些?是否均被授权?如果后续推荐的研究者是未被授权的研究者,又该如何衔接沟通知情及开具筛选期检查?
机
研究者开具检查的账号是否可用?根据SEV及SSU期间收集的信息进一步确认研究相关的所有检查是否都可以开具, 如果SSU期间已沟通需要在外院检查的部分或者SIV时临时有发现不能在本院做的检查,则需要立即报告项目组并和中心确定好外院检查的可行性计划。相关检查是否有特殊要求(例如是否需要提前预约)。受试者筛选时若需要登记IWRS系统,对应的账号研究者是否开通?
料
受试者筛选的ICF是否准备好现行版本?受试者筛选后所需要的样本管理表格、中心版本的处方签、药物相关表格是否都准备好了?
法
整个受试者筛选-知情-筛选期检查是否都符合相关法规要求。例如:是否整个过程的工作可能涉及非授权人员的参与?
环
研究者和受试者谈知情的地点是否独立隐私?受试者签署知情后需要做检查的有哪些,具体位置在何处?例如,如果涉及到分院检查的项目,受试者如何进行,是否可能会产生费用,是否可以报销等。受试者知情在哪-受试者做检查分别在什么地方-做完检查之后受试者的安排情况-在何处领取报告单-研究者在哪里进行报告审核和入组评估,整个流程中中间是否有衔接不畅的地方?
时间
研究者推荐了受试者-由谁谈知情-谈了知情何时完成知情同意病历-进行受试者系统登记-何时开具筛选期检查(哪些检查分别需要怎么预约,哪天可以做哪些检查)-每出来一份检查/检验报告后研究者如何获取/何时可以进行评估(这个过程中CRC和研究者如何配合)-完成所有检查之后研究者如何核对入排及对筛选期检查查漏补缺-确定受试者随机用药。
繁忙的启动访视后,我们也需要对本次访视的情况进行汇总报告,包括但不限于:
1. 和申办方/医学/PM跟进启动会上未解答的问题并及时反馈研究者。“事事有回应”是我们后续和研究中心维持良好沟通的必要条件;
2. 启动访视报告按要求时限提交定稿并发送随访信;
3. 与研究中心定期且高频率沟通,跟进受试者筛选情况;
4. 按照公司和项目要求,归档SIV产生的相关文件。

启动会是各研究中心相关人员最齐全的现场,对CRA的控场及应变能力有不小的挑战,前期的充分准备,不打无准备之战能让我们更从容的应对现场的突发情况。希望本期的分享能起到抛砖引玉的作用,真正帮助大家充分认识和了解启动会的重要性,并能在未来的工作中举办好每一场启动会!
✦
•
✦

- 排行
