翎课堂 | 干细胞疗法:引领神经系统疾病治疗的新纪元
发布时间:2024-11-02 09:31分类: 无 浏览:448评论:0

干细胞,被誉为“生命的种子”,是一类具有自我更新能力和多向分化潜能的细胞。干细胞技术作为生物医学领域的璀璨明珠,为全球医疗健康产业带来革命性的变革。特别是在神经系统疾病的治疗领域,干细胞疗法以其独特的再生与修复能力,展现出了前所未有的潜力与希望。近期“翎距离”直播系列聚焦“干细胞在神经疾病方面的应用”,为大家提供了一个全面而深入的视角,共同探索干细胞疗法的无限可能。
本次在线课程完整视频可前往视频公众号观看。
李惠梅
ClinChoice昆翎 高级医学经理

干细胞概述及分类
干细胞是一类具有自我更新和多向分化潜能的细胞,一般可分为成体干细胞、人胚干细胞和诱导多能干细胞等不同类型,每种类型干细胞的来源和特点有所不同。

干细胞作用机制复杂多样,包括替代与修复受损或死亡的细胞、激活休眠或处于抑制状态的细胞、旁分泌作用、免疫调控以及促进细胞间信号转导等多个方面。这些机制共同发挥着治疗作用,为多种疾病的治疗提供了新的可能。

政策法规解读及临床试验现状
为更好地规范和指导干细胞产品的研发,各国监管机构也相继发布了多项政策和技术指导原则,虽有差异,但都强调了“安全性”和“有效性”评估。在中国,干细胞产品实行双轨制监管,由国家卫健委和药监部门分别负责备案制和注册制。目前,通过备案的机构已达140多家,备案项目涉及多个系统疾病和适应症。2023年6月所发布的《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》,为干细胞药物临床试验的设计提供了重要指导。
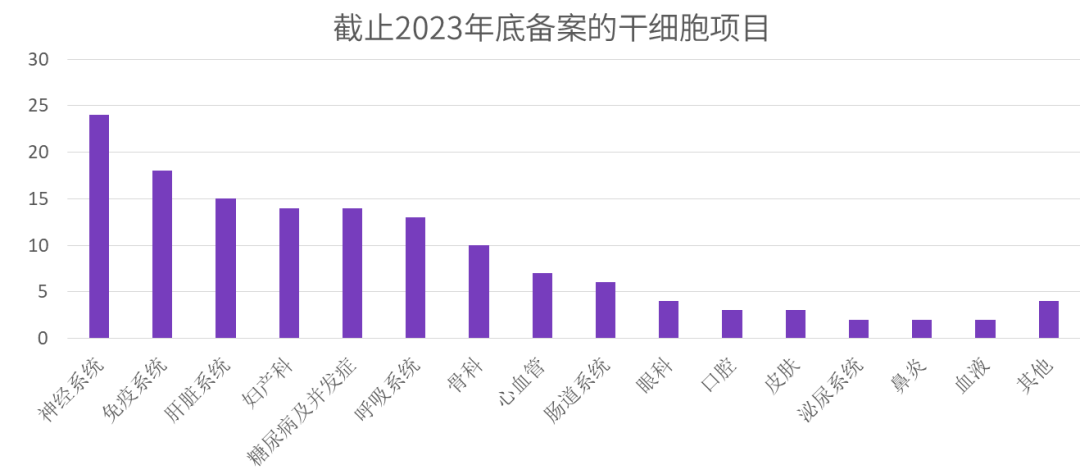
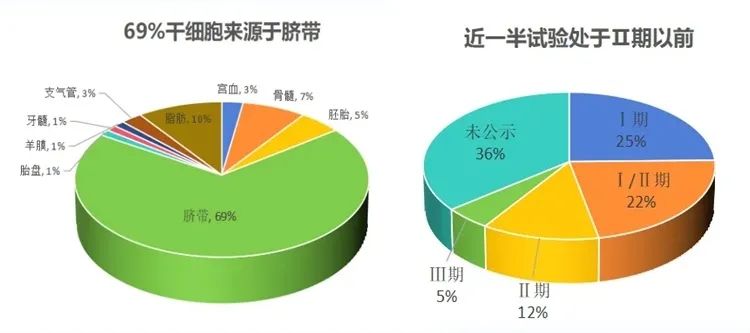
图片来自于“干细胞焦点”
纵观临床试验现状,截至2024年9月,国内干细胞临床试验项目已超过百项,主要类型为间充质干细胞,以脐带来源占比最高。虽暂无产品获批上市,但已有多项试验进入三期阶段;我们也看到针对膝骨关节炎、移植物抗宿主病等疾病的治疗展现出潜力,适应症涵盖关节炎、呼吸窘迫综合征、肺纤维化等多个领域。从全球市场来看,目前已有14款干细胞产品在韩国、日本、欧盟等国家上市。

干细胞在神经系统疾病治疗领域的应用进展
神经系统疾病分为神经退行性疾病(阿尔兹海默症、帕金森、亨廷顿舞蹈症、肌萎缩侧索硬化)和神经损伤性疾病(脑创伤、脑出血、脊髓损伤、多发性硬化)。干细胞在神经系统疾病治疗中,通过细胞的替代、分泌、免疫调节及内源性修复等多种机制,直接分化为神经细胞以修复组织,或通过旁分泌作用促进神经再生、血管再生,抑制炎症反应,从而改善神经系统功能。尽管干细胞治疗面临递送方式、细胞类型及给药剂量选择等方面的挑战,但已有临床研究证实其有效性和安全性,为神经系统疾病患者带来了新希望。
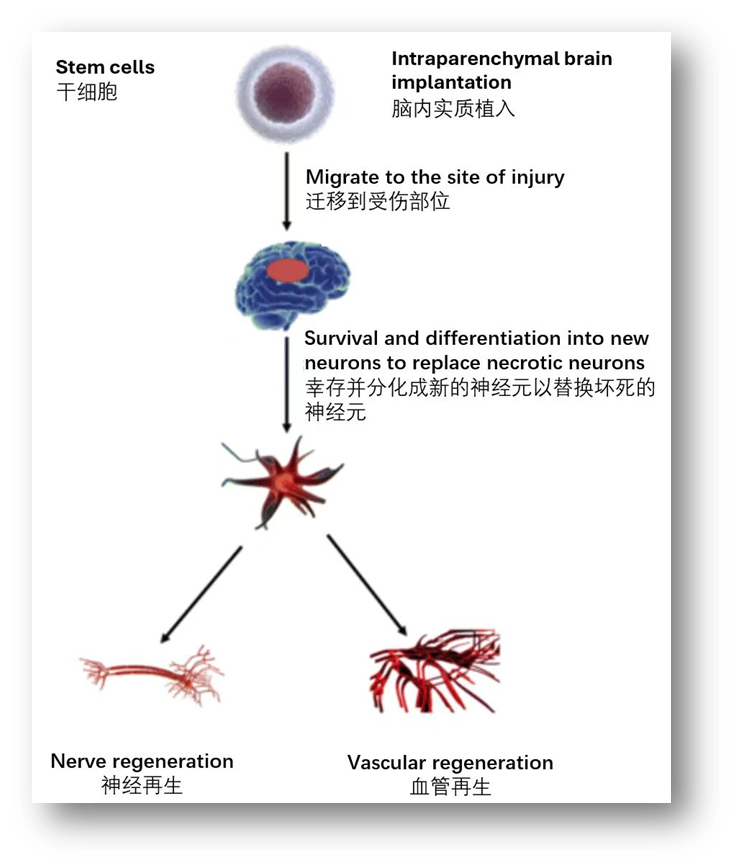
从适应症维度来说,因为干细胞作用机制复杂,涉及多种因素共同作用,所以在选择适应症时,应从产品特点出发,考虑它的免疫调节、修复作用等特性,并与疾病的发病机制相呼应。通过科学有效的验证,确认干细胞在特定适应症上的安全性和疗效。目前,许多企业选择通过IIT研究以初步了解干细胞的安全性和有效性,再进一步确认适应症,这种方式相对行之有效。未来,随着研究的深入和技术的改进,干细胞治疗有望在神经系统疾病领域取得更多突破。

实操问题,答疑解惑
Q
如何看待目前的干细胞产品在注册研究前开展IIT研究的必要性?
A
干细胞在注册研究开展之前开展IIT研究虽然并非药品研究的必需步骤,但在实际研发过程中具有重要意义。这一研究通常是在干细胞产品的非临床研究数据取得一定成果后,研发企业为初步评估产品在人体内的安全性和有效性而进行的。
从实践角度看,IIT研究能够为干细胞产品的注册研究提供宝贵的初步安全性和有效性数据支持,有助于研发企业更好地了解产品在人体内的作用,为后续的研发工作奠定基础,有效的支持注册研究的开展。
Q
干细胞产品受试者的入排标准有哪些?
A
在干细胞临床研究的受试者入组过程中,需严格根据方案规定的适应症筛选患者,入组常规治疗失败或无有效治疗手段的受试者可提高研究的风险承受力。干细胞产品由于其特殊的治疗机制,在开展的临床试验中多会伴随常规治疗,研究中一般也会明确,不中断受试者的现有治疗,但应尽量保证常规治疗药物在临床试验中的使用频率和剂量保持不变,以提高试验结果的可解读性。结合研究的适应症,如帕金森项目中,需排除有严重非运动症状如认知、抑郁等可能干扰研究结果评价的患者。同时,评估患者对给药方式的接受度及影像学检查等后续检查的可行性。总之,入组过程需综合考虑多种因素,根据适应症和方案设计要求进行综合评估。
Q
细胞设计一期DLT爬坡试验时,具体怎么定义DLT,不同产品定义的DLT有何不同?关注的点是哪些?如果某一产品不入血的话,是否就不需要进行DLT血液学毒性?干细胞与免疫细胞,如NK,在定义DLT上有何不同?
A
干细胞产品在定义DLT时应关注与试验药物相关的3级及以上不良事件。注意结合产品的特点,设置合适的DLT观察期,以便能够充分观察到产品的毒性反应。
除静脉给药外的其他给药途径也需要进行DLT观察,包括血液学毒性和非血液学毒性。
干细胞产品与免疫细胞产品的安全性风险不同,DLT定义有很大差异。如CAR-T产品常见的细胞因子释放综合征(CRS)和神经毒性,在干细胞产品中可能不会发生,所以DLT定义也会明显不同。从目前的研究来看,干细胞产品的安全性风险较低,所以在临床试验中可接受的毒性会较低。
总结来说,我们看到从阿尔茨海默病、帕金森病到脊髓损伤等,干细胞治疗正逐步展现出其独特的再生和修复能力,为患者带来新的治疗希望。未来,随着个性化医疗和精准医疗的兴起,干细胞治疗将更加符合患者的个性化需求,为更多难治性疾病提供有效的治疗方法,我们也期待干细胞的持续应用,为患者带来更多的可能。

- 排行

