来源:药时空
摘要:抗肿瘤治疗是本世纪的主要研究主题之一。现代方法已被实施以靶向并增强细胞静药对肿瘤的效果,并减少它们的普遍性/非特异性毒性。在这种情况下,抗体-药物偶联物(ADCs)代表了一种有希望且成功的策略。本综述的目的是评估有关ADCs的不同方面。从化学和药理学角度介绍了它们,并讨论了结构、偶联和开发特点以及效果、临床试验、安全性问题以及这些药物未来使用的展望和挑战。
代表性的例子包括但不限于ADCs的以下主要结构组成部分:单克隆抗体(曲妥珠单抗、布伦图珠单抗)、连接体(pH敏感、还原敏感、基于肽、基于磷酸盐等)、有效载荷(多柔比星、emtansine、ravtansine、卡利奇霉素)。关于药物治疗的成功,与ADC治疗相关的高效期待得到了大量正在进行的临床试验的支持。首先讨论了开发策略等主要方面,优势和劣势,安全性和有效性,提供了对主题的回顾性见解。综述的第二部分是前瞻性的,聚焦于克服先前确定的困难的各种计划。

1. 引言
尽管第一种抗癌药物在20世纪40年代就已引入治疗中,但直到今天,大约80年后,癌症仍然是全球范围内一种严重的疾病。目前,在抗癌治疗中,人们不断尝试接近那些限制了经典疗法众多缺点的治疗策略。尽管化疗在多种肿瘤治疗策略中发挥着重要作用,但它也存在一些限制其使用的缺点,例如缺乏对肿瘤细胞的选择性、药物在肿瘤部位的浓度不足、肿瘤细胞对化疗产生耐药性的可能性,以及这些药物的高度系统毒性。对癌症的细胞和分子生物学认识的进展,为发现和开发新的诊断和治疗代理提供了重大机遇,以管理这种病理状态。
最近,利用新的生物技术、纳米技术和靶向分子疗法作为现代癌症治疗方法,出现了创新的抗肿瘤策略。在新的治疗策略中,单克隆抗体和免疫治疗药物促进了新的个性化治疗方案(称为个性化医疗)的出现,这些方案在患者中展示了显著的疗效和最小的毒性。抗体-药物偶联物(ADC)由一个靶向肿瘤的单克隆抗体(mAb)通过连接体与一个活性化疗分子共轭而成。这些ADCs为肿瘤细胞提供了选择性,具有mAbs的高度特异性靶向优势和化疗药物极强的细胞毒性效应,以实现对癌细胞的精确和有效破坏。ADCs在治疗中的演变如图1所示。因此,靶向输送系统最初是在1897年由Paul Ehrlich提出的。他构想了一种药物靶向病原体代理的方式,同时不伤害健康细胞。自那时以来,已经取得了几项进展,例如将抗体与甲氨蝶呤链接用于白血病靶向细胞,提出放射性免疫治疗代理和ADCs的概念,并使用动物模型测试非共价和共价链接到ADCs。1975年,Milstein和Kohler使用杂交瘤技术获得了具有预定特异性的mAb。

图1. 治疗中ADCs的演变
在1980年到1990年之间,进行了针对肿瘤疾病的第一批ADCs的临床试验,但由于毒性增加和效果相对有限,结果并不令人满意。一个例子是,将嵌合抗Lewis Y(Le(Y))单克隆抗体与多柔比星偶联的I期临床试验,BR96-Doxorubicin (BR96-Dox),用于治疗表达Le(Y)抗原的肿瘤患者。同时,也开发了第一种人源化抗体,注意到小鼠单克隆抗体作为ADC开发中的高限制的免疫原性问题,因为它们的增加细胞毒性,卡利奇霉素被用于ADC开发,并且研究了BR96-Dox ADC在异种移植模型中的有效性(图1)。后来,在2000年,美国食品药品监督管理局(FDA)批准了第一种ADC药物gemtuzumab ozogamicin (GO)用于成人急性髓系白血病患者,这标志着ADC药物在抗癌治疗中有目的和针对性策略的开始。
2010年,该药物撤出市场,但后来在美国(2017年)和欧盟(2018年)重新上市。大约十年后,在2011年,Brentuximab vedotin (BV) 已获批准用于治疗霍奇金淋巴瘤和系统性间变性大细胞淋巴瘤,随后是adotrastuzumab emtansine (T-DM1),于2013年获批用于实体瘤(乳腺癌)。后者在人表皮生长因子受体2 (HER2) 上显示出比其他药物更高的特异性,同时也是首个可用于实体瘤的抗体药物偶联物 (ADC)。
截至2021年12月,全球已有14种ADC获得美国食品药品监督管理局 (FDA) 和欧洲药品管理局 (EMA) 批准,用于治疗血液恶性肿瘤和实体瘤。其中,T-DM1、enfortumab vedotin、fam-trastuzumab-deruxtecan 和 sacituzumab govitecan 被批准用于治疗实体瘤,而其他药物则用于治疗血液恶性肿瘤。提高这些化合物效率的策略旨在实现最准确的剂量,以更好地穿透肿瘤,从而最小化毒性,以便扩大ADCs的治疗益处。
目前,有100多种ADC化合物处于不同的临床试验阶段,旨在逐步取代传统的化疗。与传统的细胞毒性药物相比,ADCs具有许多优势,将单克隆抗体的靶向优势和药代动力学特性与细胞毒性有效载荷的高杀伤癌细胞能力相结合。通过这种方式,管理了具有狭窄治疗指数的药物的毒性,而不会影响健康细胞。与通常缺乏对癌细胞的选择性的常规化疗不同,ADCs通过内吞作用将ADC-抗原复合物内化,然后将其定向到作用目标地点进行解体,释放有效载荷以选择性地破坏癌细胞,最小化了非靶向细胞毒性效应。
然而,有几个因素导致ADCs对癌细胞的选择性受限,导致其毒性:(1) 连接体-药物键的不稳定性可能导致有效载荷过早释放到循环中(与有效载荷相关的毒性);(2) 如果用于mAb偶联所需的靶抗原在非恶性细胞中表达,这可能影响细胞毒性药物的分布和积累位置,导致与有效载荷无关的毒性;(3) ADCs与抗体受体的结晶片段区域 (Fc) 结合(FcγRs、FcRn 和 C型凝集素),这有助于它们被非恶性细胞摄取。本综述的目的是提供关于ADCs的多方面信息。讨论了结构、偶联和开发特性以及效果、临床试验、安全问题和这些药物未来使用的前景和挑战。由于已经发表了关于药物偶联物的许多综述,我们的目标是将ADCs的化学方面与药理学方面、临床考虑和这些药物的安全问题结合起来,从而为读者提供更好的理解。本叙述性文献综述中提供的信息可以用于未来的研究。
2. ADCs的结构方面
如图2所示,ADC的主要组成部分是三个基本元素:单克隆抗体、连接体和有效载荷。
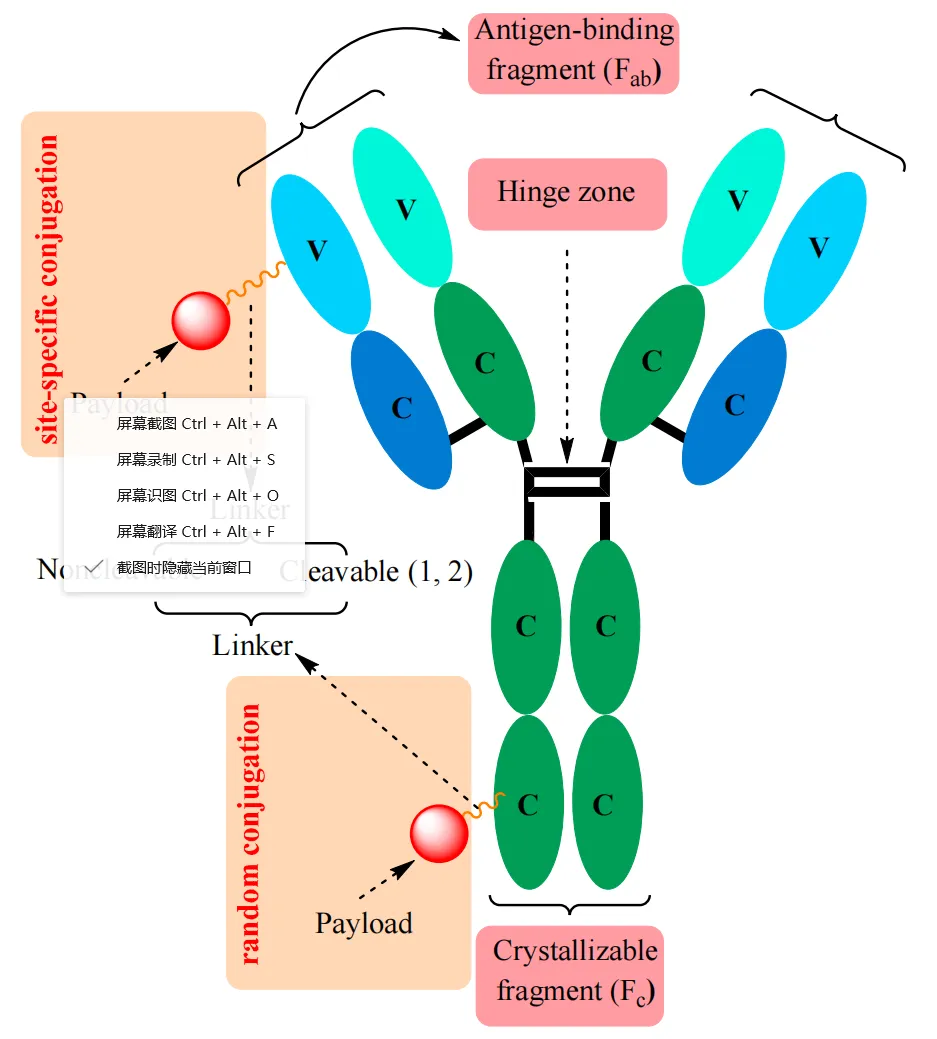
图2. ADCs的主要组成部分包括:1)化学可裂解的连接体;2)酶可裂解的连接体。
2.1. 单克隆抗体
所有抗体都有一个共同的基本结构(见图2),由两条重多肽链(绿色)和两条轻链(蓝色)组成,它们都由序列上恒定(C)或可变(V)的不同区域组成。它们通过一系列的链间和链内二硫键以及不同的非共价相互作用组装成Y形结构。附着在重多肽链上的短糖链增强了mAb的水溶性,位于抗体中部的灵活的“铰链”区域使其能够适应靶细胞表面上抗原的各种排列。
mAb是ADC结构的主要组成部分。它对于目标抗原与ADC之间的特异性结合至关重要,这种结合特异性针对肿瘤细胞上主要表达的抗原,其作用是将有效载荷(细胞毒性药物)运送到目标作用位点。为了最大化ADC的效力,选择抗体时必须优先考虑在正常组织中表达最小或不存在的、特征明确的抗原,同时最小化非靶向毒性。在ADC药物开发的初期阶段,使用了来自实验动物(小鼠)的抗体。然而,这种方法由于免疫原性引起的严重副作用,导致高失败率。在过去的几十年中,随着重组DNA技术的发展,小鼠抗体已大多被嵌合、人源化或人类(完全人源化)抗体所取代,后者显示出显著降低的免疫原性。
另一个重要方面是ADC-抗原复合物的内化效率,这取决于抗体与抗原的结合亲和力。适当的亲和力对于ADC-抗原复合物的快速内化至关重要。在ADCs中经常使用的mAbs是人类IgG亚型,它们具有长半衰期的优势,以及增强的抗体依赖性细胞介导的细胞毒性和补体依赖性细胞毒性,对抗癌细胞。
IgG1是ADCs中常用的亚型,也是血清中最普遍的类型,具有重要的效应功能,如抗体依赖性细胞介导的细胞毒性、抗体依赖性吞噬作用和通过与Fc受体增加的附着亲和力的补体依赖性细胞毒性。由于其快速的清除率,IgG3较少被包含在ADCs中。一般来说,IgG抗体的高分子量(大约150 kDa)经常对通过毛细血管和肿瘤组织的扩散构成挑战。这就是为什么在ADCs的设计中,特别是针对实体瘤,打算通过去除Fc段来减小抗体的大小。
2.2. 连接体
将细胞毒素与抗体结合的连接体旨在在循环中保持稳定,并将细胞毒素输送到目标细胞内。连接体在将细胞毒素活性分子输送到肿瘤组织、癌细胞的水平上起着至关重要的作用。
为了构成一个选择性和强大的ADC的结构组织,连接体必须具备以下基本特性:(i) 在血液中具有适当的稳定性,以防止细胞毒素药物的过早释放和非靶向效应,同时能够将有效载荷有效地输送到目标癌细胞;(ii) 连接体必须确保ADC具有良好的溶解性,以进行生物偶联;(iii) 连接体与mAb的结合不应影响抗体的附着特异性。
连接体的结合位点和选择对ADCs的稳定性和药代动力学至关重要,由连接体给出的有效载荷的化学计量决定了它们的均一性和稳定性。主要地,根据连接体与mAb在系统循环中的稳定性以及目标释放机制,连接体被分为两类:可裂解连接体和不可裂解连接体(表1)。这些连接体在ADC的药代动力学特性、选择性、治疗指数以及总体效率方面具有重要作用。在ADC的演变和研究中,已经探索了各种连接体。可裂解和不可裂解连接体在临床前和临床研究中已被证明是安全的。连接体也可以根据它们的药物释放机制和在血液中的稳定性进行分类。
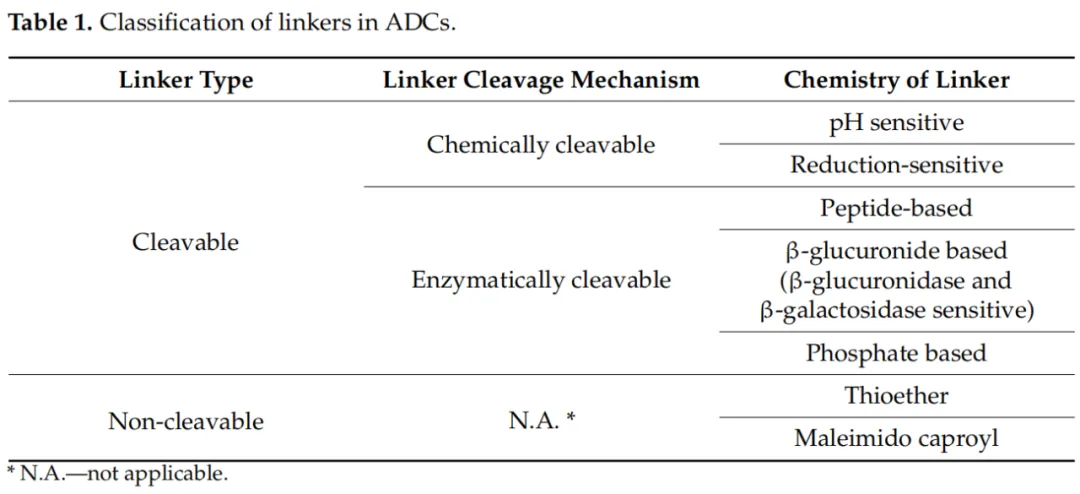
2.2.1. 可裂解连接体
可裂解连接体根据生理环境响应在目标细胞内释放药物。它们是可裂解的不稳定结构,根据一些细胞内情况如酸性pH、氧化还原反应、谷胱甘肽的主导表达或相关酶的表达,特别是溶酶体蛋白酶的作用,可以被裂解。在具有酸性pH的肿瘤微环境中,它们可以渗透到附近肿瘤细胞中,即使这些细胞不表达目标抗原,也能诱导旁观者效应。可裂解连接体被分为几个组别。
pH敏感连接体
pH敏感连接体是带有酸性基团的可裂解连接体,如腙基,它在溶酶体的低pH值下释放药物。这种策略基于利用内吞体(pH = 5-6)和溶酶体(pH = 4.8)的pH值低于细胞质(pH = 7.4)的环境。图3展示了这种连接体的一个通用示例。
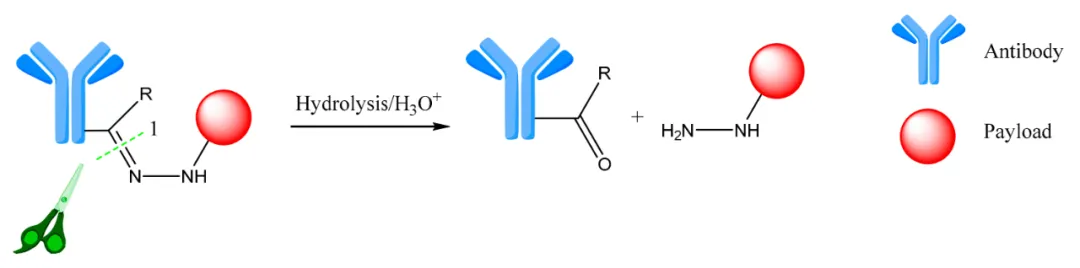
图3. 腙基连接体的裂解。1 表示水解位点。
这类连接体的一个相关例子是R96-Dox,其中活性细胞毒素阿霉素(DOX)分子通过一个酸敏感的连接体与抗体BR96的半胱氨酸(Cys)残基相连,该连接体阻止了DNA复制,是一个腙基连接体(6-马来酰亚胺己酰基)与人类化单克隆BR96相连(见图4)。
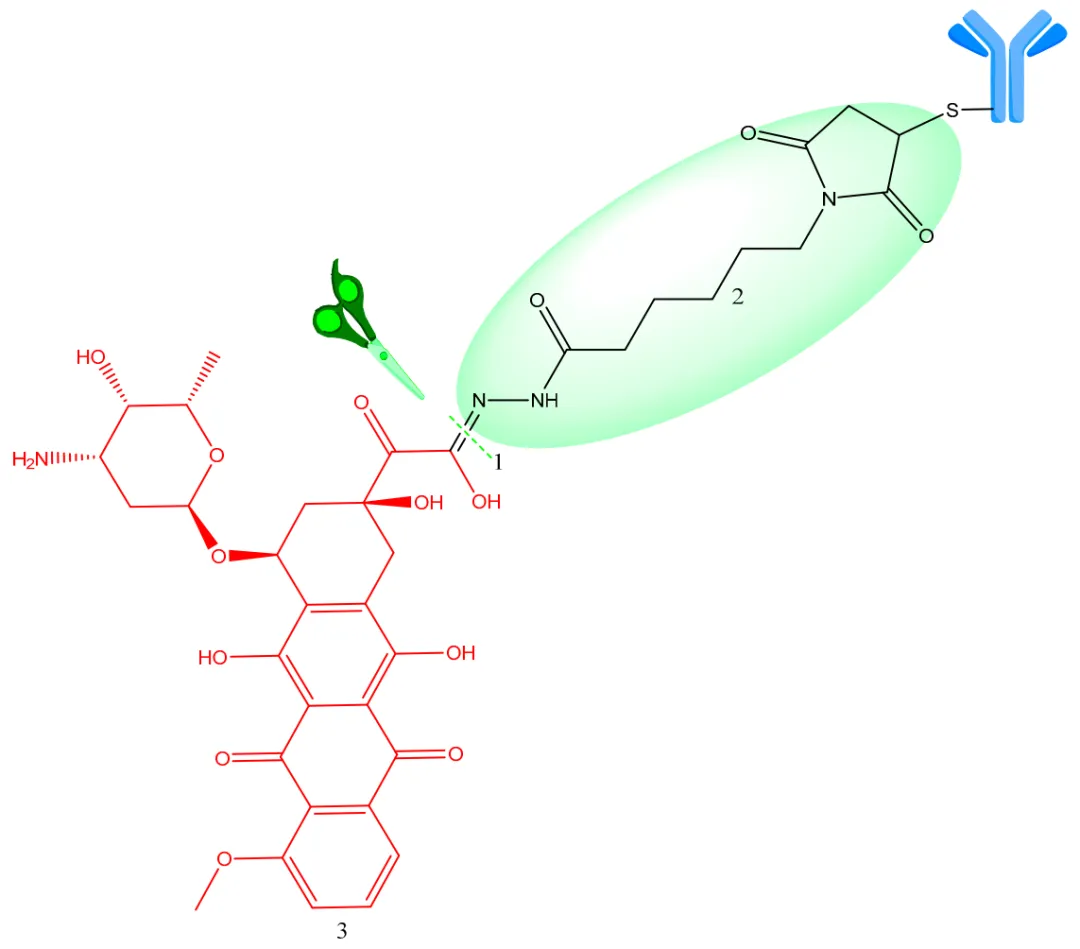
图4. BR96-阿霉素ADC结构。1—水解位点;2—(6-马来酰亚胺己酰基)腙基连接体(绿色高亮);3—有效载荷(阿霉素)(红色)。
有时,这种类型的连接体在生理条件下可能表现出不稳定性,这限制了它的实用性。例如,2017年批准的inotuzumab ozogamicin产品,体内腙基的水解已被证明在4天内以每天1.5-2%的速率发生。这个ADC含有活性代谢物卡利奇霉素,包含一个重组人源化抗CD22抗体,通过酸敏感的腙基连接体(4-(4'-乙酰苯氧基)丁酸)连接到N-乙酰-γ-卡利奇霉素二甲基腙。
还原敏感连接体包含一个二硫键,该键容易受到谷胱甘肽的还原,利用癌细胞中存在的高浓度的细胞内谷胱甘肽。同时,它们也是在生理条件下比腙基连接体更不稳定的替代品。二硫键被封装在连接体内部,在血流中抵抗还原性裂解。优化二硫键桥的空间障碍可能减少药物过早释放。
这些连接体的可裂解ADC的主要前提是细胞内环境中的还原电位差异。谷胱甘肽在细胞复制过程中高度表达并释放,在癌细胞中以显著浓度存在。可还原连接体产生一个中性的有效载荷,能够扩散到邻近的癌细胞中,从而发生旁观者效应。坎图珠单抗拉文坦辛(huC242-SPDB-DM4)是一种具有二硫键连接体的ADC,具有二硫键连接体、靶向微管的huC242抗体和活性细胞毒素分子(见图5)。在这个过程中,ADC经历蛋白水解裂解,随后二硫键被分解以释放活性药物,然后由S-甲基转移酶进行酶促代谢。因此,展示了细胞毒素活性分子的结构和释放方式。
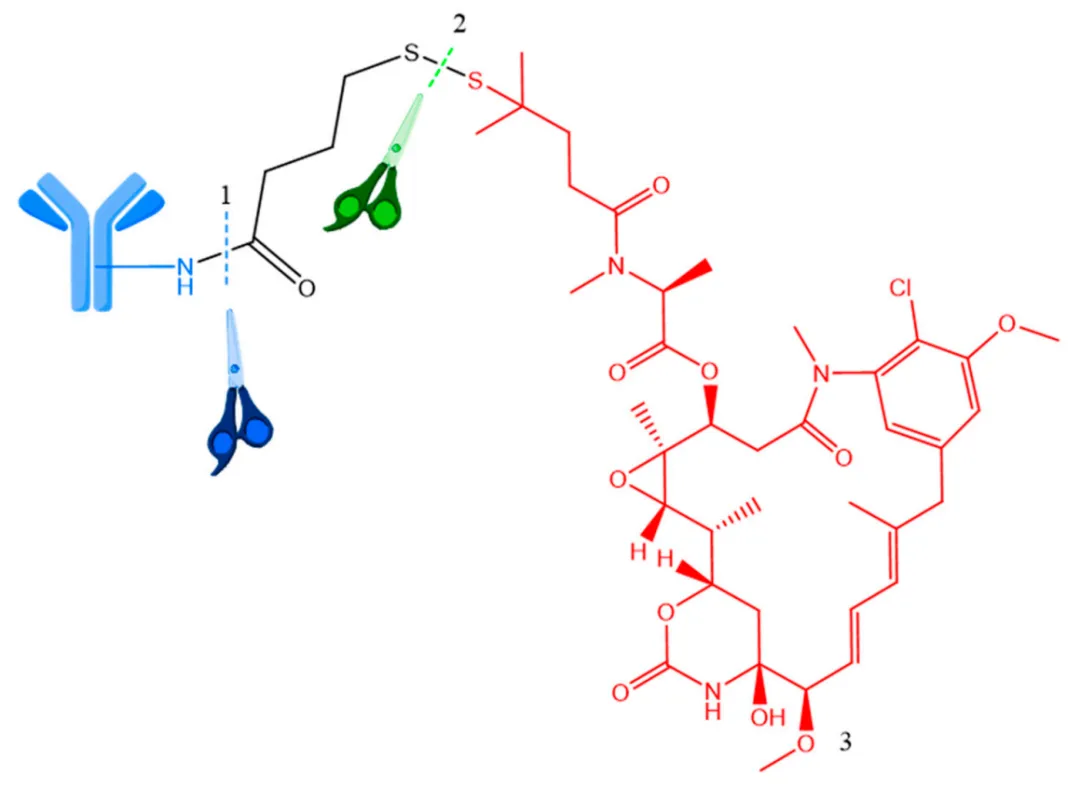
图5. Cantuzumab ravtansine (huC242-SPDB-DM4) 偶联物的裂解。1—首次裂解位点(蛋白水解);2—第二次裂解位点(细胞质谷胱甘肽还原二硫键);3—有效载荷(拉文坦辛,红色)。
为了评估曲妥珠单抗-美登素偶联物(微管解聚剂)的效力、药代动力学和毒性,进行了体外和体内研究,这些研究使用了二硫键和硫醚键连接体。结果表明,与未偶联的曲妥珠单抗或通过二硫键与曲妥珠单抗偶联的其他美登素相比,不可还原的硫醚键显示出增强的活性。
GO 是一个涉及腙键连结体和二硫键的例子。为了防止卡利霉素这种细胞毒素活性分子过早释放,并增加这种键的稳定性,在携带二硫键的碳原子α位上引入了两个甲基。在强酸性条件下,发生连结体水解,活性代谢物卡利霉素最初通过腙片段的水解被释放,然后通过细胞质中二硫键的还原产生自由的硫阴离子。随后,通过环化产生噻吩环。
基于磷酸的连结体
基于磷酸的连结体可以显著提高连结体的亲水性,尽管使用这些连结体时确切的水解机制尚未确定,但磷酸/焦磷酸结构是获得ADCs(抗体药物偶联物)的一个有希望的新型连结体。因此,传统的对卡他蛋白B敏感的Val-Cit-PAB连结体被一种磷酸二酯结构所取代,并合成了基于一磷酸、焦磷酸和三磷酸二酯结构的连结体。
体外研究表明,含有焦磷酸和三磷酸二酯亲水连结体的ADCs(如图6所示)具有重要优势。它们比一磷酸二酯更快地被裂解。在代谢焦磷酸二酯时,ADCs最初被水解为有效载荷的一磷酸代谢物,然后迅速释放活性分子。
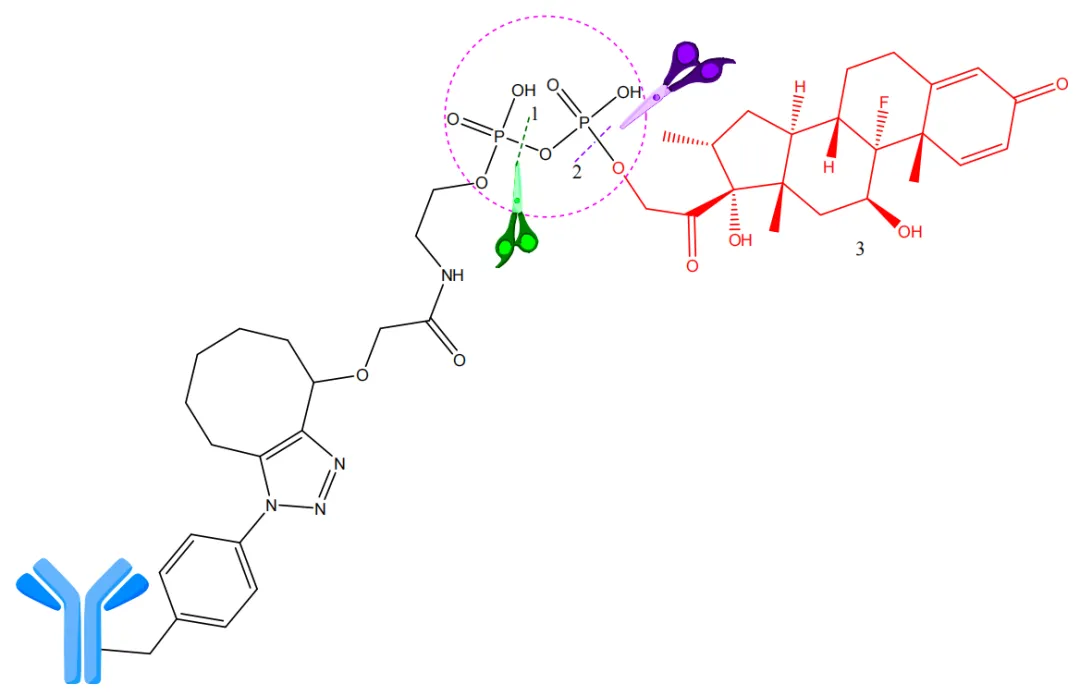
图6. 在溶酶体中,焦磷酸二酯连结体通过焦磷酸酶和磷酸酶被水解。1—焦磷酸水解位点(由焦磷酸酶催化);2—磷酸水解位点(由磷酸酶催化);3—有效载荷(地塞米松)(红色)。阴离子连结体磷酸/焦磷酸在水中的溶解度比传统连结体高,同时具有非常好的稳定性。此外,在内吞后,焦磷酸二酯通过内吞体-溶酶体途径迅速被水解,释放出未改变的活性分子。还开发了一种特殊的基于焦磷酸酶的连结体,用于抗CD70的ADCs,它可以释放含有羟基、地塞米松和丙酸氟替卡松的有效载荷。
基于肽的连结体
基于肽的连结体的作用是在系统循环中保持ADCs不变,并促进通过特定的细胞内蛋白酶(如卡他蛋白B)水解来释放细胞毒素分子。图7中示意性地表示了这种水解(蛋白水解反应和溶酶体中的水解筛)。
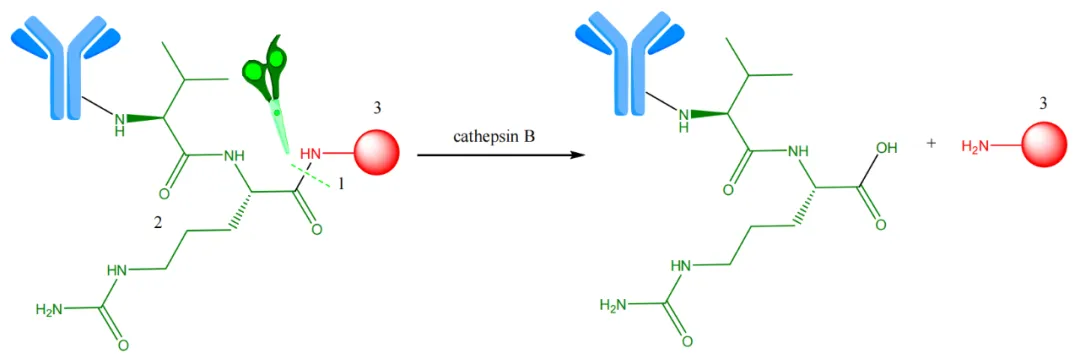
图7. 在溶酶体中,卡他蛋白B对Val-Cit连结体进行酶催化水解。1-酶催化水解位点;2—Val-Cit连结体(绿色);3-有效载荷(红色)。
卡他蛋白B是一种溶酶体蛋白酶,它在不同的癌细胞中过度表达,具有相当广泛的底物范围,但它偏好识别苯丙氨酸-赖氨酸(Phe-Lys)和缬氨酸-瓜氨酸(Val-Cit)序列。这些序列的C末端末端分裂肽键。与对氨基苄氧羰基(Val-Cit-PABC和Val-Ala-PABC)偶联的Val-Cit和缬氨酸-丙氨酸(Val-Ala)连结体是ADC中最容易水解的连结体之一。由于不适当的pH水平和血清蛋白酶抑制剂的存在,这些肽连结体,如二肽连结体Val-Cit或Phe-Lys,在促进目标细胞内快速酶催化药物释放的同时,展现出增强的系统循环稳定性。这种连结体在许多ADC中使用,其优点是保持ADCs在血浆中的稳定性,并有利于在细胞内蛋白酶作用下进行水解。因此,BV是一个ADC的例子,其中细胞毒素活性分子通过自降解(卡他蛋白B敏感的PABC)连结体与抗CD30抗体偶联。虽然含有这种连结体的ADCs通常在生理条件下稳定,但在实验动物实验中发现一种未知的丝氨酸蛋白酶酶催化水解了连结体。
基于β-葡萄糖醛酸苷酶的连结体
β-葡萄糖醛酸苷酶是水解性的溶酶体酶,仅位于细胞的溶酶体隔室,并且在细胞外环境中具有酶催化活性。这些酶将β-葡萄糖醛酸分子降解为多糖,并在亲水介质中活性,以从偶联物中释放有效载荷。这种水解在图8中示意性地显示。
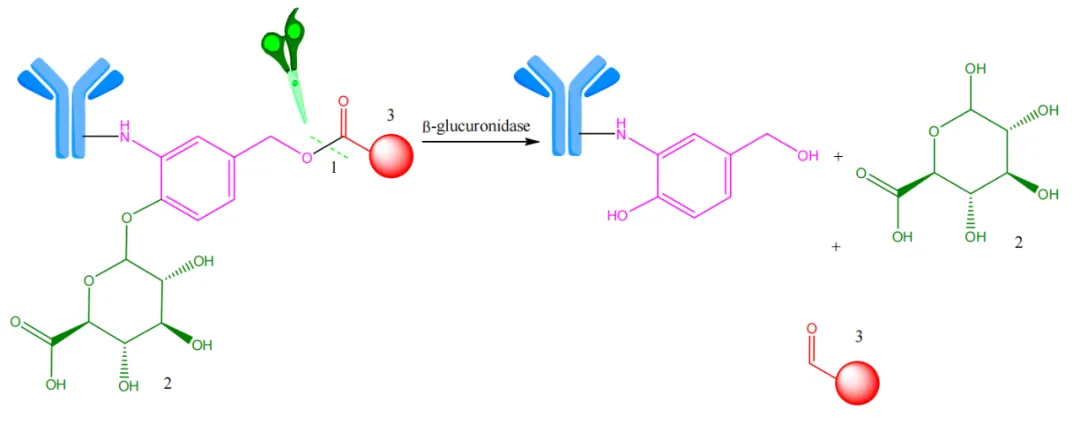
图8. 在溶酶体中,β-葡萄糖醛酸苷酶对β-葡萄糖醛酸苷连结体进行酶催化水解。1-酶催化水解位点;2—基于β-葡萄糖醛酸苷的连结体(绿色);3-有效载荷(红色)。
自降解基团的引入提高了连结体的稳定性,并促进了细胞毒素活性分子的安全释放。β-葡萄糖醛酸苷连结体已被用于将多种单克隆抗体(mAbs)与多种细胞毒素药物偶联,包括auristatin衍生物单甲基auristin E和F以及propyloxazoline阿霉素。除了利用auristatins和doxorubicin,这种方法还用于针对特殊类别的细胞毒素剂,如蒽环类抗生素、喜树碱衍生物、紫杉醇类、氮芥衍生物和组蛋白去乙酰化酶抑制剂。
2.2.2. 非可裂解连结体
从结构上讲,非可裂解连结体有两种类型,即硫醚或马来酰亚胺己酰(MC)。这些连结体形成稳定的键,抑制了蛋白水解裂解,并与可裂解连结体相比,在血浆中提供了增加的稳定性。采用这种连结体的ADC依赖于抗体的完整溶酶体酶降解,以实现内吞后的载荷释放,导致连结体同时脱落。带有非可裂解连结体的ADC首先需要ADC被内吞,并且mAb通过溶酶体蛋白酶降解,以传递活性分子(图9)。因此,在设计ADC时,选择非可裂解连结体而不是可裂解连结体是一个特定策略的决策,其中复合物的稳定性比活性片段的快速释放更为重要。这些连结体可以具有不同的长度、极性、有利的稳定性和灵活性,因此可以用于不同类型的ADCs。
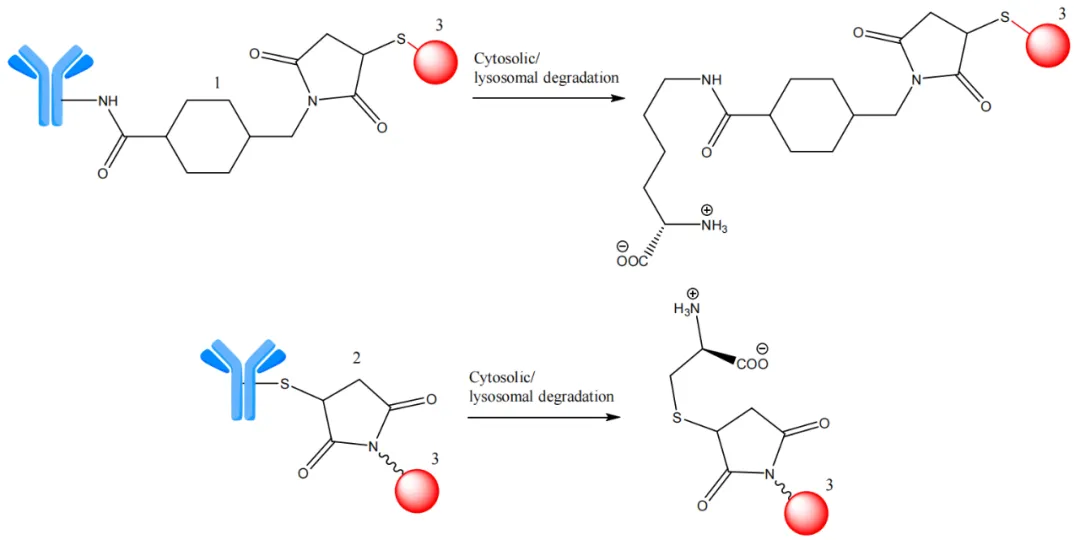
图9. 带有非可裂解连结体的ADCs在细胞质/溶酶体中的降解。1—MC;2—硫醚连结体;3—有效载荷(红色)。
在ADC研究中,已经研究了几种非可裂解连结体,典型的是N-琥珀酰亚胺-4-(N-马来酰亚甲基)环己烷-1-羧酸酯,存在于曲妥珠单抗emtansine中,它与抗HER2曲妥珠单抗mAb的赖氨酸(Lys)残基共轭,形成细胞毒素活性分子(图10)。这类结构的代谢产物主要为Lys-SMC-DM1作为肿瘤的主要代谢物。此外,连接到这些连结体的药物通常不能发挥旁观者效应,因为释放的代谢产物细胞渗透性降低。
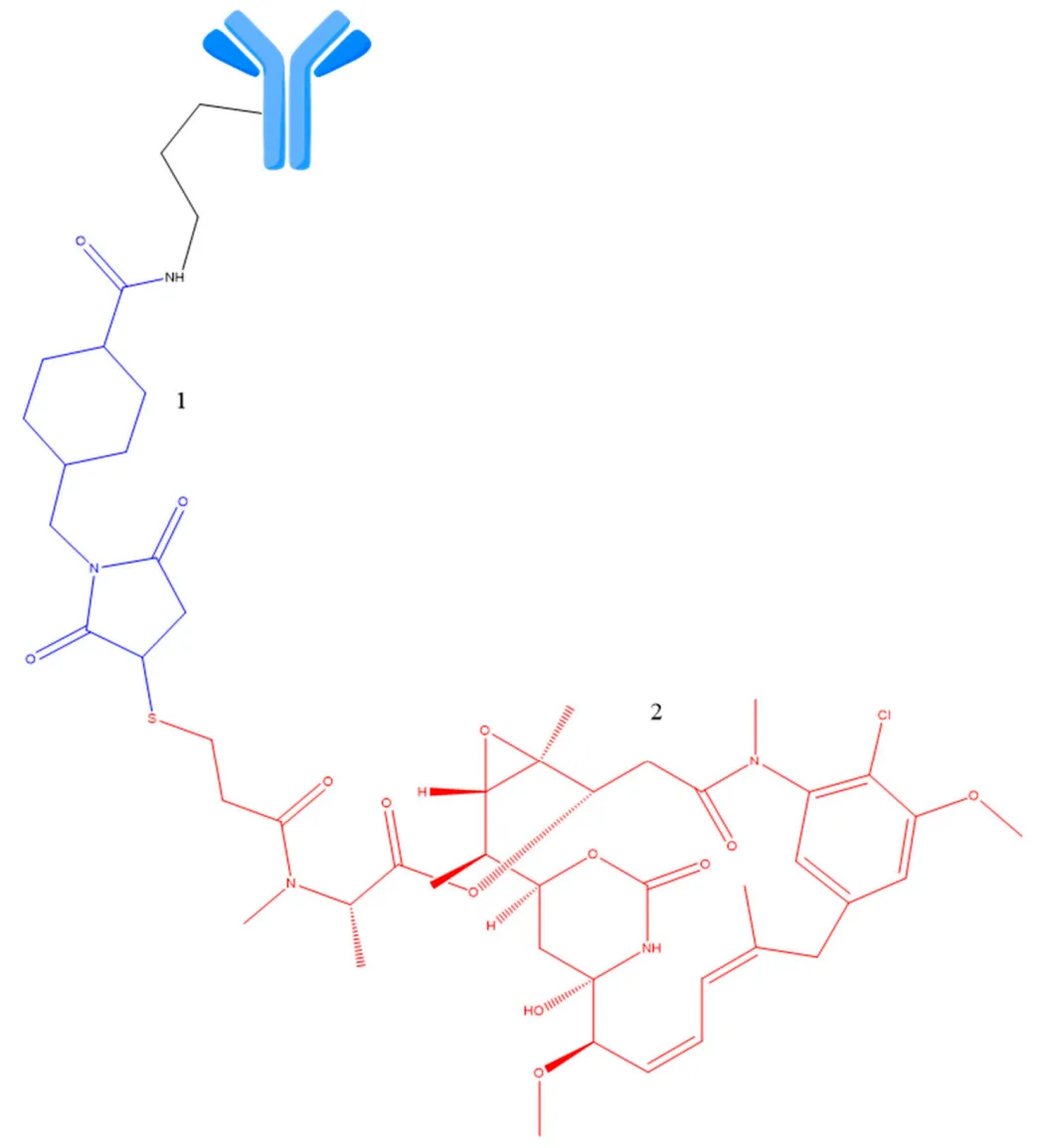
图10. 曲妥珠单抗emtansine的结构。1—非可裂解SMCC连结体(蓝色);2—有效载荷(emtansine,红色)。
与可裂解连结体相比,非可裂解连结体的主要优点在于提高了血浆稳定性,可能带来更宽的治疗窗口。此外,预计它将减少脱靶毒性,因为不可分离的ADCs具有更高的稳定性和耐受性。为了通过与单克隆抗体和细胞毒素药物偶联来设计和选择适当的连结体,已经进行了许多研究,这些是能够改变ADCs的稳定性、毒性、药代动力学特性和药效学的组成部分。每个连结体都有其优点和缺点,因此在其选择和使用时必须考虑许多方面。因此,选择合适连结体的决定考虑了mAb中现有的基团、细胞毒素药物产品中的活性基团以及衍生的官能团。最佳连结体确保了细胞毒素药物在血液中的足够稳定性,有效抑制了药物的早期释放,并有效地促进了细胞毒素药物释放到目标肿瘤细胞中,从而提高了ADC在其整体中的效率和耐受性。
2.3. 有效载荷
有效载荷是通过连结体与mAb偶联的细胞毒素活性分子。随着时间的推移,诸如细胞因子、放射性核苷酸和各种毒素等许多分子已被建议作为有效载荷,但目前大多数FDA/EMA批准的ADCs与具有广泛结构和作用机制的小型细胞毒素分子共轭。ADCs在溶酶体裂解后或由于环境变化(如氧化还原电位)的结果,将有效载荷释放到细胞内环境中。细胞毒素活性分子的高活性至关重要,因为它与对目标组织的高选择性密切相关。有效载荷结合到目标上,如微管或基因组DNA,从而抑制肿瘤细胞增殖。
ADCs中有效载荷主要分为两类:微管抑制剂(美登素类或auristatin类)和影响DNA的药剂(拓扑异构酶抑制剂或穿行DNA之间)。ADCs中有效载荷需要满足几个重要条件:
(i) 高细胞毒性能力,与显著的亲脂性质相关;(ii) 有效载荷的靶点必须位于细胞内:(iii)
) 活性细胞毒素分子应体积小,无免疫原性,并在水缓冲溶液中具有适当的溶解度,以便在最佳条件下进行偶联;(iv) 有效载荷在血浆中必须稳定。
美登素类(图11)如美登素是美登素的合成衍生物,是微管聚合的抑制剂。美登素有两类衍生物:DM1和DM4。DM1包括emtansine和mertansine,DM4包括soravtansine和ravtansine。它与微管蛋白结合,导致有丝分裂停滞和细胞死亡。曲妥珠单抗-emtansine偶联物DM1(T-DM1)是首个获准用于治疗实体瘤的ADC。
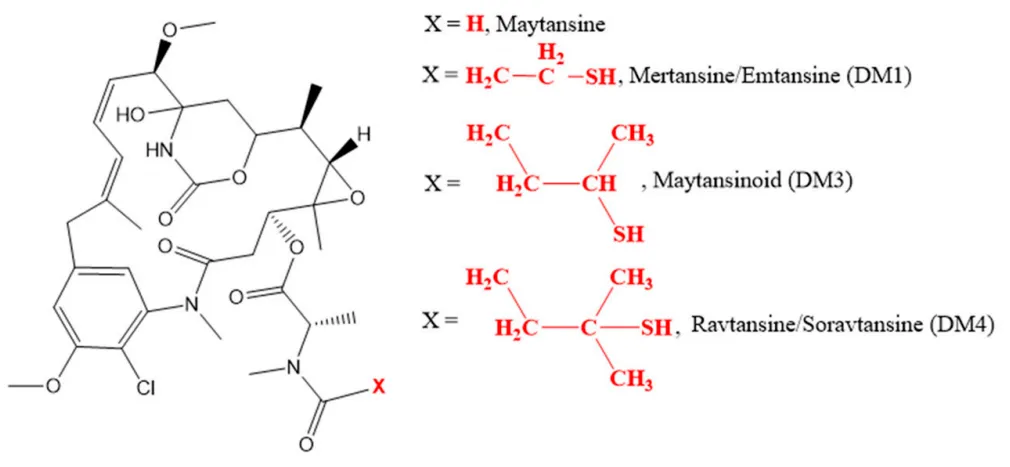
图11. 美登素类化合物的化学结构。
Auristatins是合成化合物,源自一种天然的抗有丝分裂药物多拉斯他丁10,该药物从海洋腹足类软体动物Dolabella auricularia中分离出来。单甲基auristatin E (MMAE)是一种非常有效的抗有丝分裂剂,通过抑制微管蛋白聚合来阻止细胞增殖。同样,单甲基auristatin F是一种新型auristatin衍生物,其C末端带有苯丙氨酸,与其未带苯丙氨酸的对应物MMAE相比,其细胞毒性降低。通过靶向微管蛋白来抑制微管蛋白聚合,导致细胞在第二生长阶段/有丝分裂(G2/M)细胞分裂阶段停止和凋亡。
其他有效载荷是作为拓扑异构酶I抑制剂的细胞毒素分子,这增加了抗肿瘤免疫反应。以下是具有作为拓扑异构酶I抑制剂的有效载荷的ADCs的例子:sacituzumab govitecan和trastuzumab deruxtecan。作用于DNA的药剂包括卡利霉素、吡咯并苯并二氮杂环二聚体(PBD)、吲哚喹啉二氮杂环、二苯并喹啉、二苯并氮杂环和阿霉素。例如,二苯并氮杂环和PBD的二聚体通过将烷基自由基结合到富含鸟嘌呤的区域来引起DNA烷基化,卡利霉素引起双链DNA断裂,导致细胞凋亡。
3. 抗体-药物偶联及效率
抗体偶联和细胞毒素有效载荷可以影响ADCs的药代动力学和治疗指数。传统的药物偶联通常发生在mAb主链上,通过赖氨酸侧链的烷基化或酰化,如在GO和曲妥珠单抗emtansine中采用的方法,或者通过二硫键的还原释放半胱氨酸残基与连结体结合,如在BV中使用的。ADCs中的传统药物偶联策略是随机的,导致ADCs的异质混合物以及不同的药代动力学特性、疗效和安全性。迄今为止,所有批准的ADCs都是通过非特异性修饰Cys或Lys抗体残基的偶联反应获得的,或者使用还原的二硫键结构连结体,不可避免地导致异质偶联物,其治疗效果有限。
通过半胱氨酸残基的偶联过程导致抗体的四个链间二硫键部分还原,生成多达八个反应性巯基。然后,部分还原的抗体与含有马来酰亚胺连结体的载荷偶联。例如,在用于霍奇金淋巴瘤的BV中,使用的载荷是含有可被蛋白酶裂解的马来酰亚胺连结体的MMAE。虽然与T-DM1相比,BV表现出较小的异质性,但它包含许多含有零到八个载荷的ADC分子。
评估ADC效率的一个关键因素是药物-抗体比(DAR)(图12),定义为与单抗结合的药物分子的数量。最佳DAR取决于有效载荷的性质。DAR差异很大,取决于偶联位点和使用轻链或重链偶联的ADC的其他变量。DAR值影响药物疗效,因为低药物载荷导致效力降低,而增加药物载荷可能影响毒性和药代动力学(PK)。目前,批准的ADCs的DAR值为2-8。一些最近批准的具有DAR为八的ADCs对PK最佳DAR值为四提出了质疑,特别是由于增强的疏水性掩盖技术。通过定位活性分子将mAb偶联到连结体的技术对于实现均匀和控制的DAR至关重要。
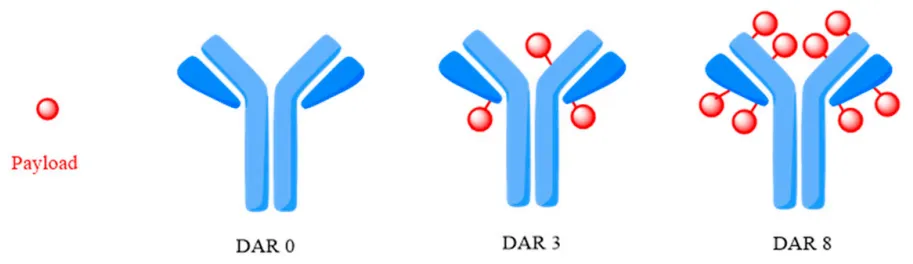
图12. 药物-抗体比(DAR)示意图。
通常,DAR增加的ADCs在体外更具活性,并且更快速地分布到血浆中。例如,在体外,BV的生物活性取决于DAR值。在对实验小鼠进行的临床前研究中,DAR为8的ADC比DAR为2的版本显示出血浆清除速度快5倍,但并未显示出细胞毒性活性的增强。这种行为与抗体-连结体复合物的疏水性增加密切相关,可以通过使用不影响血浆清除的亲水结构来绕过(例如,对于sacituzumab govitecan(SG),更高的DAR与体内更高的抗肿瘤活性相关)。SG是通过将抗Trop-2(hRS7)IgG抗体与SN-38(irinotecan的活性代谢物)通过CL2A连结体片段偶联得到的。内化抗体IgGκ RS7–3G11(RS7)最初在小鼠中开发,用于与Trop-2结合,具有纳摩尔级的亲和力,后来被替换为用于临床的人源化mAb。根据使用的偶联方法,可以产生具有不同DARs和结合位点的ADC物种混合物。靶向特异性偶联方法使用修饰残基、修饰糖基、酶联和化学交联剂,提供具有定义DAR的更均匀产品。半胱氨酸和赖氨酸结合模式通常导致DAR中的异质混合物。无论偶联的氨基酸(半胱氨酸或赖氨酸),所得到的ADCs都是具有类似高斯分布的DAR的异质产品,这突出了两个潜在问题:(i)产品中可能剩余有限数量的未偶联抗体,从而附着并填充ADC附着位点,降低效力;(ii)DAR较高的ADCs在体外更活跃,体内耐受性较差,并且比DAR较低的值更快清除。
存在两种偶联类型:随机偶联和位点特异性偶联(SSC)。通常,随机偶联占主导地位,但位点特异性偶联的功能和分析优势被强调。为了避免这些困难,SSC方法允许合成均匀的ADCs,优化偶联位置,提高生物活性,并进行分析表征。在半胱氨酸上的SSC方法是设计具有半胱氨酸残基和链间二硫键的mAbs,允许进行马来酰亚胺偶联,以利用现有的载荷。通常应用生物偶联程序将mAb连接到连结体和载荷。总体而言,偶联过程对于获得ADC的每种技术至关重要。这一步决定了生物偶联物的性质和特征,并显著影响偶联效率。有效的偶联策略极大地有助于任何ADC的成功。典型的偶联方法包括赖氨酸残基的随机偶联和mAbs铰链区还原半胱氨酸残基的偶联,以及近年来开发的SSC技术,这是近年来的主要关注点。这些方法包括在抗体序列中引入修饰的半胱氨酸残基或非天然氨基酸,或通过转谷氨酰胺酶和糖基转移酶进行酶联偶联。尽管DAR特性可以通过特定的偶联技术进行调节,但SSC方法可以导致更均匀的药物产品,可以提高产量和生物物理特性。蛋白质工程方法已经实现了在特定位置战略性地放置残基,允许化学选择性偶联反应。因此,偶联稳定性取决于能够增强治疗指数的特定修饰半胱氨酸位点,同时增加偶联稳定性和PK特性。

在表2中,使用不同策略优化一些ADCs的有效性的方法,针对DAR进行了概括[75,85]。长期以来,DAR为四一直被视为最佳,但最近的研究表明,这适用于具有DM或MMAE作为载荷的第二代连结体的ADCs,如mirvetuximab soravtansine(DAR 3.5)(图13)、抗BCMA thiomab-amanitin(DAR 2)和depatuxizumab mafodotin(DAR 4)。
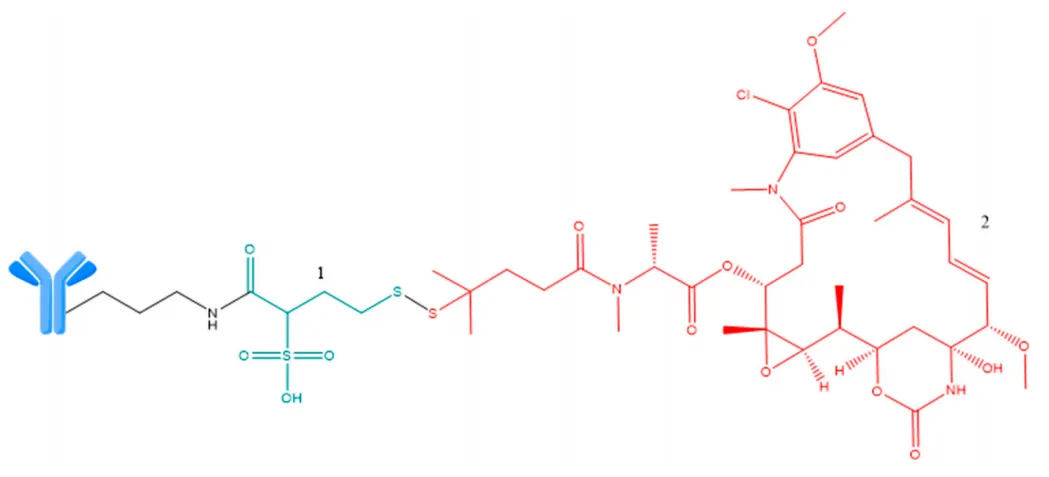
图13. Mirvetuximab soravtansine ADC结构。1-可裂解的Sulfo-SPDB连结体(绿色)2有效载荷(ravtansine,红色)。
一个高DAR并不减少活性载荷的治疗效力的例子可以在SG中看到,SG是一种与SN-38偶联的mAb抗TROP-2。这种ADC通过附着在人源化IgG TROP-2抗体上,有利于在肿瘤水平释放大量SN-38,TROP-2是一种在超过90%的三阴性乳腺癌(TNBC)病例中表达的表面糖蛋白。这种ADC的成功表现在其在TNBC中的适应症上,TNBC在FDA于2020年4月批准SG之前没有治疗。这种ADC另一个不寻常的方面是,包含聚乙二醇单元的连结体结构的增强,结果获得了DAR高达7.6的ADC,而没有减少其耐受性或效率。
另一个高DAR的ADC的例子是一种exatecan衍生物(DXd),一种体外活性比SN-38强十倍的细胞毒素剂,具有更好的安全性,特征是更好的溶解性,对邻近癌细胞具有旁观者效应,这对异质性肿瘤是有益的,并且具有短半衰期以避免脱靶毒性。通过敏感于蛋白酶的马来酰亚胺连结体将DXd生物偶联到trastuzumab抗HER2的半胱氨酸残基上,使得能够生产出具有均匀DAR 7.7的fam-trastuzumab deruxtecan偶联物(DS-8201a)。
4. ADCs的开发
ADCs的开发策略已经从第一代发展到第三代ADCs:
(i) 第一代的特点是使用小鼠单克隆抗体和非可降解连结体,缺乏对肿瘤组织的精确靶向和高细胞毒性。
(ii) 第二代ADCs的特点是一些额外的改进,获得了具有增强目标选择性、使用减少免疫原性的人性化抗体、更有效的载荷和稳定连结体的ADCs,这些连结体已经显示出高效力和临床安全性。然而,仍然存在缺点,包括未偶联抗体的存在和高DARs,导致脱靶毒性、ADC聚集、药物的代谢降解增加以及快速清除。
(iii) 第三代进一步改进了以前的缺点,采用特定的偶联优化技术,将DAR降低到大约2-4,减少未结合抗体的比例,从而提高ADCs的效率。此外,分数剂量方案是一种可以扩大治疗指数的策略,可以减少由系统循环中ADCs的最大浓度引起的毒性,延长ADCs在肿瘤组织中的暴露时间,并保持剂量强度以确保抗肿瘤效力。
第四代ADCs正在探索使用非天然氨基酸突变体和酶催化偶联技术来提高药物的均一性和DAR的精确性。这些技术允许在特定的氨基酸残基上进行选择性偶联,从而实现更均匀的ADCs,具有更好的治疗潜力和更低的毒性。此外,第四代ADCs还专注于开发新型有效载荷和连结体,以提高ADCs的整体性能和安全性。
4.1. 第一代ADC
第一代ADCs由作为DNA干扰剂的细胞毒素分子(卡利霉素、SN-38、二苯并氮杂环、多柔比星)组成。这些有效载荷通过单价、不可裂解的键或酸敏感的连结体与mAbs偶联。它们不是完全稳定的,并且治疗指数狭窄,但它们代表了治疗学上的重要第一步。1990年代进行的研究表明,在ADCs中使用人源化mAbs以实现更有针对性的作用。
这种新的ADC策略受到各种缺点的影响,从不愉快的副作用到连结体问题,以及在直接向肿瘤部位输送足够剂量方面的挑战。因此,最初的ADCs创造策略主要受到以下缺点的支配:(i) 药物效力—循环血清浓度不在治疗范围内:肿瘤细胞仅表达少量抗原分子,ADCs在细胞内释放的有效载荷不足以满足细胞破坏所需的阈值浓度。此外,细胞内输送的ADC分子数量通常少于附着在细胞表面的那些的数量;(ii) 目标抗原表达—它们针对的受体缺乏对肿瘤的足够选择性,导致不可接受的毒性水平;(iii) 连结体稳定性—使用的连结体要么过于稳定(导致效力减弱和效率降低),要么过于不稳定(导致目标特异性受损和高系统毒性)。因此,腙连结体的短半衰期(43小时)是导致非目标药物释放引起不必要的毒性的原因。这些第一代连结体的使用导致在循环中有效载荷解离水平增加,导致非选择性细胞毒性。
连结体不稳定在2000年代仍然是一个重要问题,例如GO,在48小时内释放了其一半的有效载荷进入循环。由于这个设计缺陷,GO与其他疗法相比,与增加的死亡率有关;(iv) 免疫反应—在最初的ADCs中使用的mAbs要么是嵌合的,要么是小鼠的,导致免疫反应和产生人抗小鼠抗体,这阻碍了重复治疗周期的施用能力。
因此,从第一代和早期第二代ADCs中得出的mAb免疫原性、连结体稳定性和有效载荷效力等关键概念,成为极其重要的方向。GO的DAR为2-3,被FDA批准用于CD阳性淋巴性白血病,靶向CD33。这种ADC被目标肿瘤细胞内吞,通过水解连结体释放卡利霉素,并通过诱导双链DNA断裂,停止细胞周期并诱导目标肿瘤细胞凋亡。后来发现GO与其他经典细胞毒素药物相比没有显著优势,并且具有严重的肝毒性,它自愿退出市场。GO的潜在治疗缺点包括连结体的不稳定性(它在大约48小时内释放了50%的有效电荷)以及活性电荷,卡利霉素具有高亲脂性,以至于与单克隆抗体的结合比例为50%,从而导致高毒性。研究还表明,gemtuzumab mAb可以通过外排泵从细胞中移除。2017年,第一代的第二种ADC,inotuzumab ozogamicin,被批准。它是一种通过酸敏感连结体与卡利霉素偶联的人源化单克隆抗体,用于表达CD22标记的急性淋巴细胞性白血病。这种新的ADC的优点是与传统细胞毒素化疗相比,表现出较少的不良副作用。
4.2. 第二代ADC:位点导向偶联
第二代ADCs是从第一代的缺点和不足出发开发的,特别是随着mAb技术的显著进步,以及mAbs亚型、细胞毒素有效载荷和连结体的发展。因此,选择mAbs以增强对肿瘤细胞的选择性附着,同时最小化与健康细胞的交叉反应,将mAb IgG1与小分子细胞毒素偶联,比IgG4具有更高的选择性。为了解决异质性问题,研究集中在位点特异性设计的mAbs上,包括具有修饰半胱氨酸残基的mAbs,来自不同来源的氨基酸,以制造更均匀的产品。然而,大多数第二代ADCs具有狭窄的治疗窗口,由于未能达到目标,未偶联抗体竞争,以及具有从零到八的DAR的ADCs的快速聚集或消除。特定ADC的平均DAR不同:曲妥珠单抗emtansine为3.5,BV为4,inotuzumab ozogamicin为6。
在这些ADCs中,未偶联mAb物种的百分比很低,大约5%(例如,BV和曲妥珠单抗emtansine含有5%未偶联物种),它们与载药物种竞争,以附着在特定抗原上,与GO的50%未偶联物种不同。此外,观察到DAR大于四的物种通常具有较低的耐受性,增加的血浆清除率,因此体内效力降低。提高这一代ADCs效率和特异性的其他策略包括通过使用亲水连结体调节疏水性,并应用化学结构-治疗活性关系。使用更高效力的细胞毒素有效载荷,如auristatin和maytansine微管破坏剂。每个mAb上可以加载多个活性细胞毒素分子,而不触发抗体聚集。
此外,在第二代ADCs中,抗体载体和细胞毒素有效载荷的增强,以及更有效的连结体,有助于实现增强的血浆稳定性和DAR的均匀分布。这一代的连结体以其比以往连结体更大的功能性为特点,可以在细胞内或溶酶体中通过酶催化或暴露于酸来裂解,如蛋白酶、肼、聚乙二醇(PEG)和二硫键连结体。这些连结体的优势在于在正确的时间和目标地点释放有效载荷,同时确保ADC在制备、储存和系统循环中的稳定性。尽管第二代有所有优点,但仍有一些方面需要改进:由于脱靶毒性和增加的DAR导致的有效载荷的快速聚集或消除,治疗窗口不足。当DAR超过六时,ADC的亲脂性增加,其效力由于更快的体内分布和清除而趋于降低。鉴于此,通过特定偶联优化DAR,再加上连结体、有效载荷和mAbs的持续改进,可能是第三代ADCs成功发展的关键。
4.3. 第三代ADCs
第三代ADCs的研究探索扩大治疗窗口,增加它们的活性和特异性,例如开发具有两个不同结合位点的双特异性mAbs(IgG样和非IgG样)。例如,一个ADC既可以释放毒素,也可以通过旁观者效应激活自然杀伤细胞。另一种创新技术是使用抗原结合片段(Fabs)而不是完整的mAbs。这些是包含抗原结合位点的抗体部分。这些Fabs非常稳定,更容易内吞,相对容易纯化,并且往往免疫原性较低。完整抗体和抗体片段之间的主要区别在于分子大小,因此150 kDa的IgG在Fabs的情况下减少到50 kDa,甚至其他抗体片段的尺寸更小。通过获得具有良好表征的DAR(两个或四个)和最佳细胞毒性以及更好的药代动力学效率的均匀ADCs,确立了位点特异性偶联技术的发展优势。
2019年,FDA批准了polatuzumab vedotin、enfortumab vedotin和fam-trastuzumab deruxtecan;2020年4月,sacituzumab govitecan被批准用于TNBC。两种较新的ADCs(sacituzumab govitecan和loncatuximab tesirine)在它们的连结体技术中加入了PEG链,以提高体内溶解度和稳定性。这一代ADCs的制造技术专注于治疗靶向。因此,MEDI4276(一种双特异性抗HER2 mAb,通过maleimidocaproyl连结体与四个tubulysine部分偶联,靶向同一目标上的两个不同的非重叠表位)、vadastuximab talirine(一种通过蛋白酶可裂解连结体与两个PBD偶联的抗CD33 mAb)和IMGN779(一种通过可裂解的二硫键连结体与三个indolinobenzodiazepine部分偶联的抗CD33 mAb)是这项技术的例子。
关于第三代ADCs的批准,对于液体肿瘤,2000年,GO被批准用于急性髓细胞性白血病,2010年撤市,2017年重新获批。BV在2011年被批准用于霍奇金淋巴瘤,inotuzumab ozogamicin在2017年被批准用于急性淋巴细胞性白血病,moxetumomab pasudotox在2018年被批准用于毛细胞白血病,polatuzumab vedotin和loncastuximab tesirine分别在2019年和2021年被批准用于B细胞淋巴瘤。对于实体瘤的ADCs,trastuzumab emtansine和trastuzumab deruxtecan分别在2013年和2019年被批准用于HER2阳性乳腺癌;enfortumab vedotin在2019年被批准用于转移性尿路上皮癌;SG和cetuximab soratolacan分别在2020年被批准用于三阴性乳腺癌和头颈癌;在2021年,tisotumab vedotin和disitamab vedotin分别被批准用于宫颈癌和晚期乳腺癌;在2022年,mirvetuximab soravtansine被批准用于卵巢癌。
5. 安全问题
尽管ADCs具有益处,但其配方存在一些安全问题。其中主要问题之一是脱靶效应。这些效应是在正常细胞中产生的,因为细胞毒素药物与非目标分子结构发生相互作用。由于缺乏对肿瘤细胞的特异性,mAbs可以以很小的比例与健康细胞上表达的抗原发生相互作用,导致通过在正常组织中释放有效载荷而导致正常细胞死亡。
另一方面,正常细胞上特定抗原的表达会导致脱靶细胞毒性效应。另一个问题是肿瘤异质性。肿瘤细胞可以表达不同水平的目标抗原。其中一些呈现高水平的抗原,另一些呈现低水平的抗原,还有一些可能是阴性的。结合正常细胞中的抗原表达,这种异质性决定了药物抗性,从而间接导致疾病复发。在通过静脉途径给予的ADCs的系统循环过程中,细胞毒素药物可以通过与其他脱靶抗原结合对正常组织产生细胞毒性。由于连结体稳定性导致的早期释放有效载荷可能会导致正常组织中的脱靶效应。
此外,免疫系统可以与ADC(例如,表达Fc受体的免疫细胞)发生相互作用,从而导致其被淘汰;它还可以激活针对表达目标抗原的正常细胞的免疫反应。为了减轻ADC的细胞毒性,提出了许多策略:(i) 优化抗体特异性以针对抗原;(ii) 明智选择在正常细胞中表达比例极低但在肿瘤细胞中高度表达的靶标抗原;(iii) 使用稳定的连结体,允许在目标上释放有效载荷;(iv) 预先评估脱靶毒性;(v) 在临床试验期间仔细监测患者以管理不良反应。另一方面,使用疗效和毒性剂量之间差异很小的有效载荷是导致脱靶效应的另一个因素。
此外,ADCs的快速清除和代谢效率低下可能会导致系统毒性,包括对肝脏或肾脏等器官的毒性影响。神经学效应是ADC使用的另一个限制,特别是针对中枢神经系统肿瘤的有效载荷。在某些情况下,可能会触发针对ADC组分(mAbs,有效载荷)的免疫反应。
因此,通过使用人类或人源化抗体可以减轻ADC的免疫原性。最后,ADCs的毒性可能是与其他药物相互作用的结果。首先,ADCs可能与其他细胞毒素药物发生相互作用。一个例子是trastuzumab emtansine和pertuzumab之间的联合,即使药理动力学相互作用的风险很低。其他相互作用改变了ADC的代谢。因此,不同的酶抑制剂或诱导剂可能针对相同的酶底物,如有效载荷。例如,GO主要由CYP1A2、CYP3A4、CYP2C8等代谢;BV由CYP3A4代谢;trastuzumab emtansine由CYP3A4/5代谢;inotuzumab ozogamicin由CYP或UGT代谢,等等。
6. 临床试验
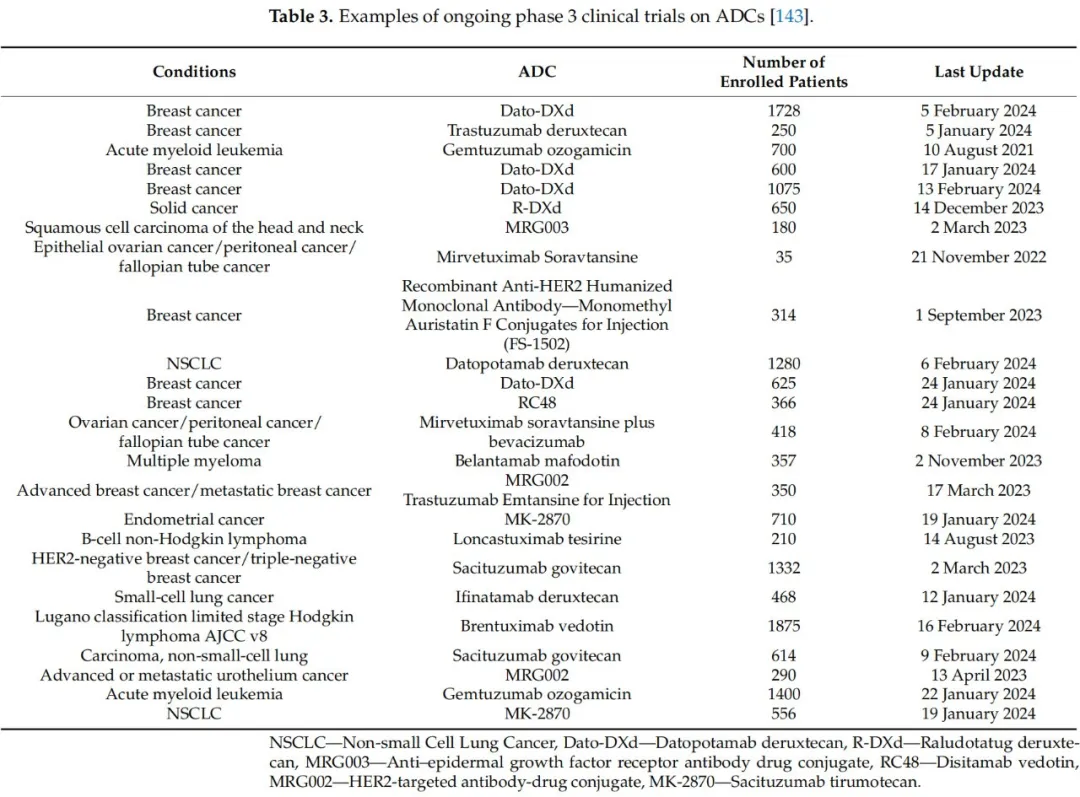
自2000年以来,已有几种ADCs获得FDA和EMA批准,用于各种血液和实体肿瘤。这些分子的研究正在不断发展,许多临床试验正在进行中。因此,科学和医学界的兴趣,以及对ADCs有效性的高期望,由ClinicalTrials.gov数据库列出的大量临床试验(截至2024年2月19日的215项)证明。截至那时,共有36项临床试验尚未开始招募患者。表3列出了截至2024年2月19日达到3期或2/3期临床试验的最有前途的一些分子。
7. 展望和挑战
传统抗肿瘤疗法的有效性,从经典的非特异性化疗到分子靶向疗法,由于经典化疗的高毒性和分子靶向疗法的细胞毒性和标记能力不足而遇到一些问题。自ADCs最初引入治疗以来,已经出现了许多比经典化疗的优势。这些包括开发对肿瘤细胞具有日益选择性的化合物,避免健康细胞,增强治疗指数和治疗窗口,克服了与化疗相关的低选择性和快速清除。此外,它们解决了靶向疗法的亚优抗肿瘤效力。尽管有这些优势,ADCs的开发和制定改善当前治疗策略仍然存在许多挑战,例如选择特定的抗原作为靶标和解决结构优化策略。
7.1. 选择特定抗原
限制性靶向肿瘤上高度均匀表达的细胞外抗原,但在健康组织中表达减少,可以提高靶向ADCs的选择性,从而降低活性载荷的毒性。重要的是要考虑实体肿瘤抗原是高度异质和动态的,因此抗原选择的范围可以扩展到阴性抗原或那些不能充分诱导肿瘤内吞的抗原,同时考虑到旁观者效应。也可以将突变的癌基因靶点包括作为潜在的抗原,特别是高表达且内吞可能性高的均匀表达的突变癌基因。通过下调表达引起肿瘤抗性的癌基因抗原,以及通过抗体介导的抑制下游信号通路产生的进一步抗肿瘤效应,可能间接优化ADC作用。
7.2. ADCs的结构优化
抗体是一类在治疗和诊断中广泛使用的生物分子,需要用特定的功能片段进行修饰,包括荧光团、活性货物和蛋白质。ADC技术中的几种方法涉及将活性货物稳定地附着在mAb中的赖氨酸或半胱氨酸残基上,这不可避免地产生不能进一步纯化的异质产品。因此,采用特殊技术通过不同酶促方法、遗传密码扩展或基因编码标记特别引入的生物正交手柄来获得均匀的抗体偶联物。随后,使用生物正交偶联反应进行功能化。所得的均匀产品已被证明在体外和体内环境中都优于异质对应物。
对于抗体的位点特异性标记策略,人们持续表现出兴趣,这一关注点源于单克隆抗体(mAb)具有高治疗指数的优势以及针对特定治疗靶标的抗体偶联物的卓越生化特性。因此,已经开发了一系列方法,用于将功能性分子通过共价键特异性地连接到抗体上。这些技术大多需要特定的抗体工程方法来插入一个独特的反应片段,然后利用生物正交化学对其进行选择性修饰。在这种准确标记天然抗体的策略中,能够以提高效率且无脱靶效应的方式选择性地修饰单个氨基酸残基是至关重要的。
例如,通过代谢工程改造半胱氨酸(Cys),在实验室动物中测试中国仓鼠卵巢细胞,采用特定的Cys涂层技术,已经开发出一种新的抗体生产工艺。这项技术便于在化学选择性还原三(3-磺酸苯基)膦后直接连接活性货物,目的是将基于Cys的位点特异性偶联与其他位点特异性偶联方法相结合,以研究ADCs并利用多重作用机制实现有效的癌症治疗。
因此,为了满足开发理想ADC的所有标准,必须考虑以下方面:
(i) 该技术应适用于任何mAb,无需事先纯化和/或化学修饰;
(ii) 标记过程不应改变mAb的结合特性。迄今为止开发的大多数ADCs都是通过随机偶联到赖氨酸或半胱氨酸残基上获得的。然而,由于抗体在其表面有大约40个赖氨酸残基暴露,还有几个半胱氨酸残基,有效载荷的结合通常会产生非常异质的混合物。随机偶联可能会改变偶联抗体的效力、安全性、药代动力学和免疫原性,因此需要策略将有效载荷附着到特定的抗体位点。
这些化学修饰的区域选择性应由标记片段控制,而不是通过抗体本身的工程或化学修饰;因此,通过模拟与适体、小分子、蛋白质或肽的化学反应,已经能够标记未修饰的蛋白质。已经对新金属介导的可裂解连结体的方法进行了研究,该方法使用单笼片段设计,旨在通过生物正交键合裂解反应实现有效载荷的严格控制释放,并通过金属的亚化学计量减少毒性,以达到所需的效果。金属介导的连结体基于钯、钌、铜和铂。
另一方面,ADC构成中的偶联策略改变了DAR的均一性、细胞毒素有效载荷的释放以及治疗靶标外的毒性。鉴于化学效率低下和免疫原性,目前正在研究新技术以更好地控制DAR和ADC的均一性。例如,使用dolaflexin平台,一种新型ADC XMT-1536,针对钠磷酸共转运蛋白II型(NaPi2b),通过水溶性聚合物连接以增强药代动力学、溶解性,同时提高免疫原性,DAR为10-12,正在评估中。
7.3. 优化抗性和毒性的策略
肿瘤对药物产生抗性仍然是一个主要挑战,因为它可能在没有明确机制的情况下发生。目前关于抗性机制的假设包括:
(i) 肿瘤微环境的变化导致药物分子进入肿瘤细胞的渗透性降低;
(ii) 一些内吞途径的缺陷适应了对有效载荷的抗性;
(iii) 抗原的下调;以及(iv) 通过ATP结合盒转运蛋白,如多药耐药蛋白1,诱导细胞毒素有效载荷的主动外排。为了提高ADCs的有效性,一些研究旨在绕过甚至阻断某些抗性机制。另一方面,毒性是限制ADCs临床使用的一个重要因素,这取决于抗原在非肿瘤组织中的生理作用、连结体稳定性、有效载荷的数量和特性,以及旁观者效应。ADCs的不良反应很重要,必须仔细监测,及时预防和治疗,并在临床使用期间适当调整剂量方案。优化ADC结构和调整剂量方案都可能作为减少毒性的潜在解决方案。
8. 结论
ADCs在治疗肿瘤疾病方面的引入,对于治疗对经典疗法和个性化医疗有抵抗性的肿瘤,是一个极为重要的进步。通过对ADCs的研究,扩大了治疗指数和适应症,并通过旁观者效应和非干扰机制克服了因抗原异质性表达而带来的限制。同时,探索早期肿瘤以及联合治疗方法也有很大的前景。此外,肿瘤药物抗性的产生机制、优化治疗策略和适当的患者个性化仍然是非常重要的课题,以及获取改进的ADCs的技术。























