Nature大子刊 | 国家纳米中心梁兴杰等提出靶向树突状细胞的疫苗递送新策略
发布时间:2025-04-16 01:17分类: 无 浏览:257评论:0

疫苗在预防传染病和治疗癌症中发挥着至关重要的作用,其中抗原呈递细胞(APCs)在诱导有效免疫反应方面扮演着关键角色,特别是树突状细胞(DCs),作为先天免疫与适应性免疫之间的桥梁,具有高效激活T细胞和B细胞的能力,因此被认为是免疫系统中最强大的抗原呈递细胞之一。正因如此,开发能够精准靶向DCs的疫苗是当前研究的重点方向。
与此同时,纳米技术在疫苗设计中的应用为疫苗研发提供了全新的机遇。纳米疫苗通过将抗原封装在纳米颗粒中,显著提高了抗原的稳定性和免疫原性。然而,尽管纳米疫苗在多项临床试验中已显示出良好的效果,目前的纳米颗粒疫苗仍存在非特异性分布的问题,容易引发不良反应,并且多数难以高效抵达DCs。

2025年2月,中国科学院大学、国家纳米中心梁兴杰教授和中国科学技术大学宫宁强教授等人的团队在Nature Biomedical Engineering上发表了题为“Targeting vaccines to dendritic cells by mimicking the processing and presentation of antigens in xenotransplant rejection”的研究论文。研究表明,异种细胞膜衍生的囊泡(XMVs)可用于DCs靶向疫苗递送。
体内预先存在的异种组织特异性抗体能与XMVs结合,形成IgG层,该层可被DCs识别,促进XMVs摄取。XMVs不仅能将抗原高效递送至细胞质,诱导DCs成熟和抗原交叉呈递,还能促进抗原向淋巴结(LNs)转运,激活DCs。在小鼠肿瘤模型中,XMVs递送抗原肽可有效抑制肿瘤生长,延长小鼠生存期。
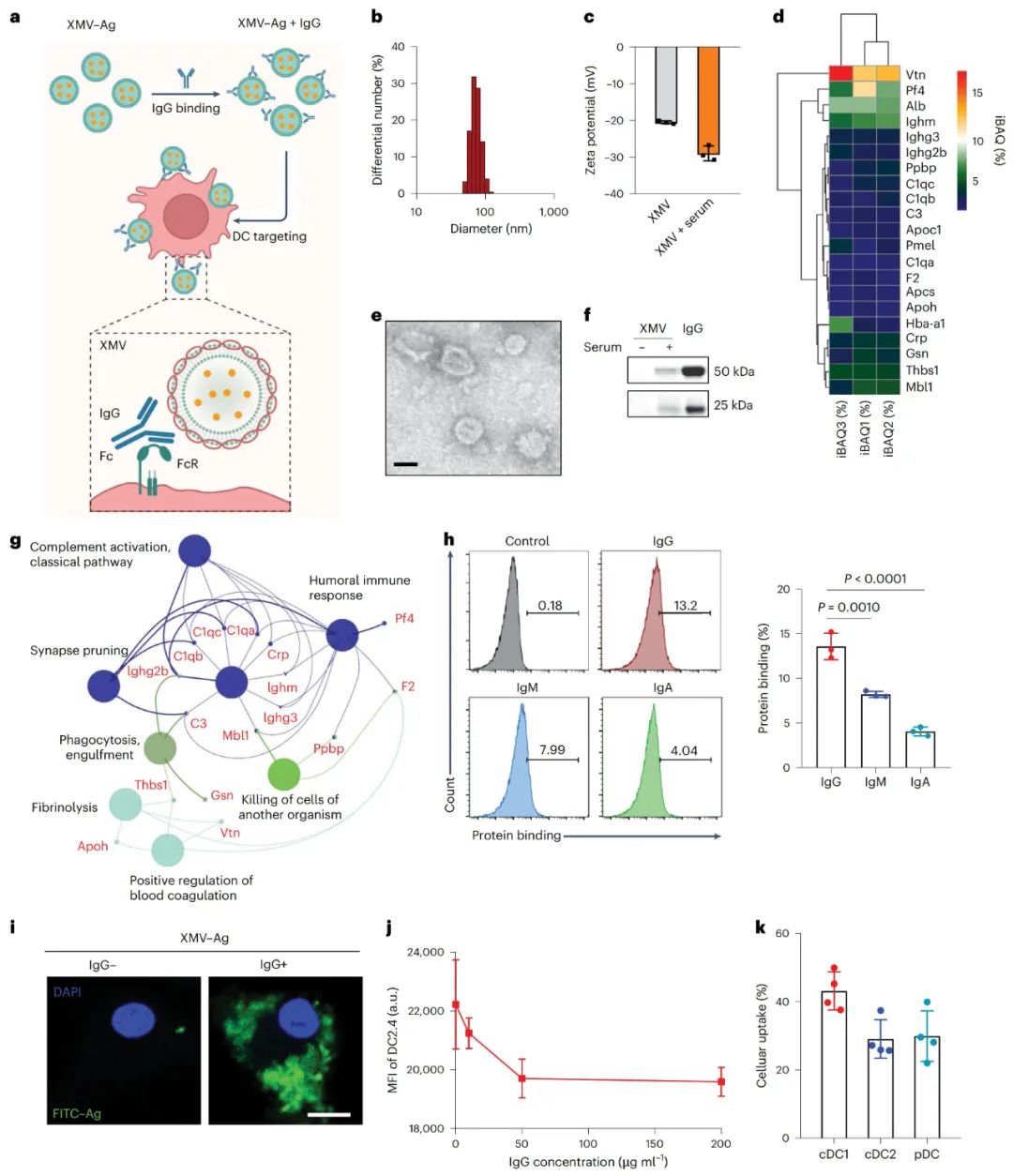
IgG结合XMVs改善DC特异性递送
通过体外实验,研究团队使用标记的小鼠IgG孵育多种异体细胞,发现体内预先存在的异种组织特异性IgG能特异性结合异体细胞,而对自体细胞的结合较少。进一步制备IgG修饰的脂质体(LIP-IgG)后发现,该修饰显著增强了DCs和巨噬细胞对脂质体的摄取,而这一摄取依赖于抗体的Fc区域。在模拟皮下环境实验中,IgG可与猪内皮细胞(PED细胞)结合,进一步证实IgG能在体内相关环境中与异体细胞结合。
此外,研究发现,不同DC亚型对XMV-Ag的摄取存在差异,表明XMV在抗肿瘤及抗病毒疫苗应用方面具有潜在优势。通过动态光散射、透射电镜和蛋白质印迹实验,研究人员证实,XMV与小鼠血清孵育后会形成富含IgG的蛋白质冠,且IgG在XMV表面的结合水平较高。
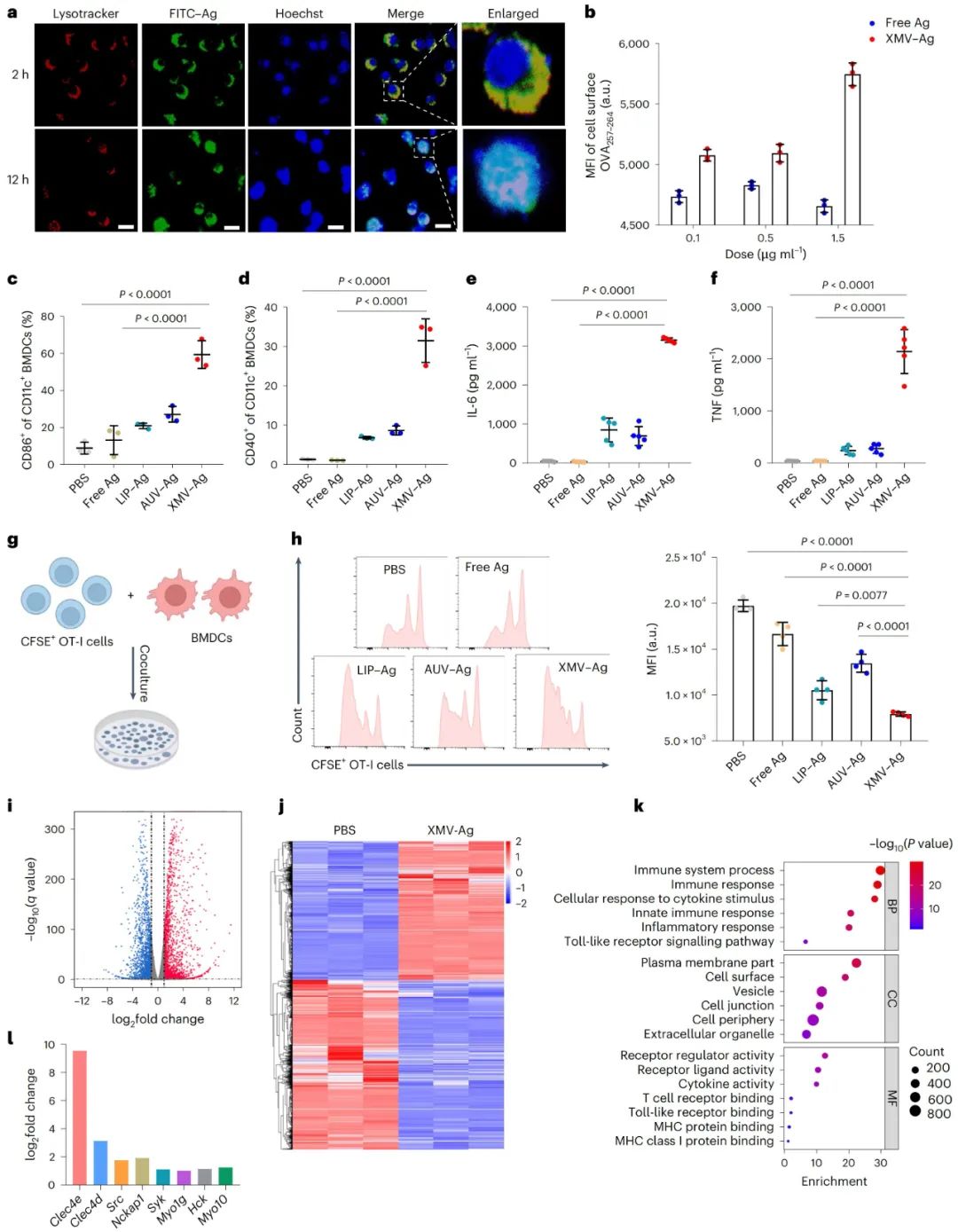
XMVs促进DC激活和抗原交叉呈递
研究团队以OVA241-270肽标记的FITC-Ag制备XMV-FITC-Ag,用其处理骨髓来源的树突状细胞(BMDCs),通过共聚焦显微镜观察发现,XMV能将抗原肽高效递送至细胞质。用XMV-Ag处理DCs后,检测到DC表面OVA抗原表位的呈现显著增强,表明XMV-Ag可诱导DCs发生抗原交叉呈递。
进一步实验显示,XMV-Ag处理的BMDCs中,共刺激分子CD86和CD40的表达上调,促炎细胞因子TNF和IL-6的分泌增加,且OT-I细胞增殖实验也证实XMV-Ag能诱导抗原交叉呈递。转录组测序结果表明,XMV-Ag处理的DCs中,与FcγR信号通路激活、DC活性、抗原加工和呈递相关的基因表达发生变化,说明XMV-Ag在体外能有效促进DC激活和抗原交叉呈递。
XMVs促进抗原向淋巴结递送
通过给小鼠皮下注射DiR标记的XMV-Ag,发现XMV-Ag能特异性地将抗原递送至淋巴结(LNs),而在肝脏、肾脏等其他器官中的信号较弱。通过流式细胞术和免疫荧光成像实验,发现XMV-Ag处理后,LNs中CD45+淋巴细胞、CD11c+DCs和CD3+T细胞的积累增加。在FcγR敲除(KO)小鼠实验中,XMV-Ag在LNs中的积累明显减少,证明Fc-FcγR相互作用有助于DC和T细胞在LNs中的积累。
XMV-Ag引发强烈的抗原特异性T细胞反应
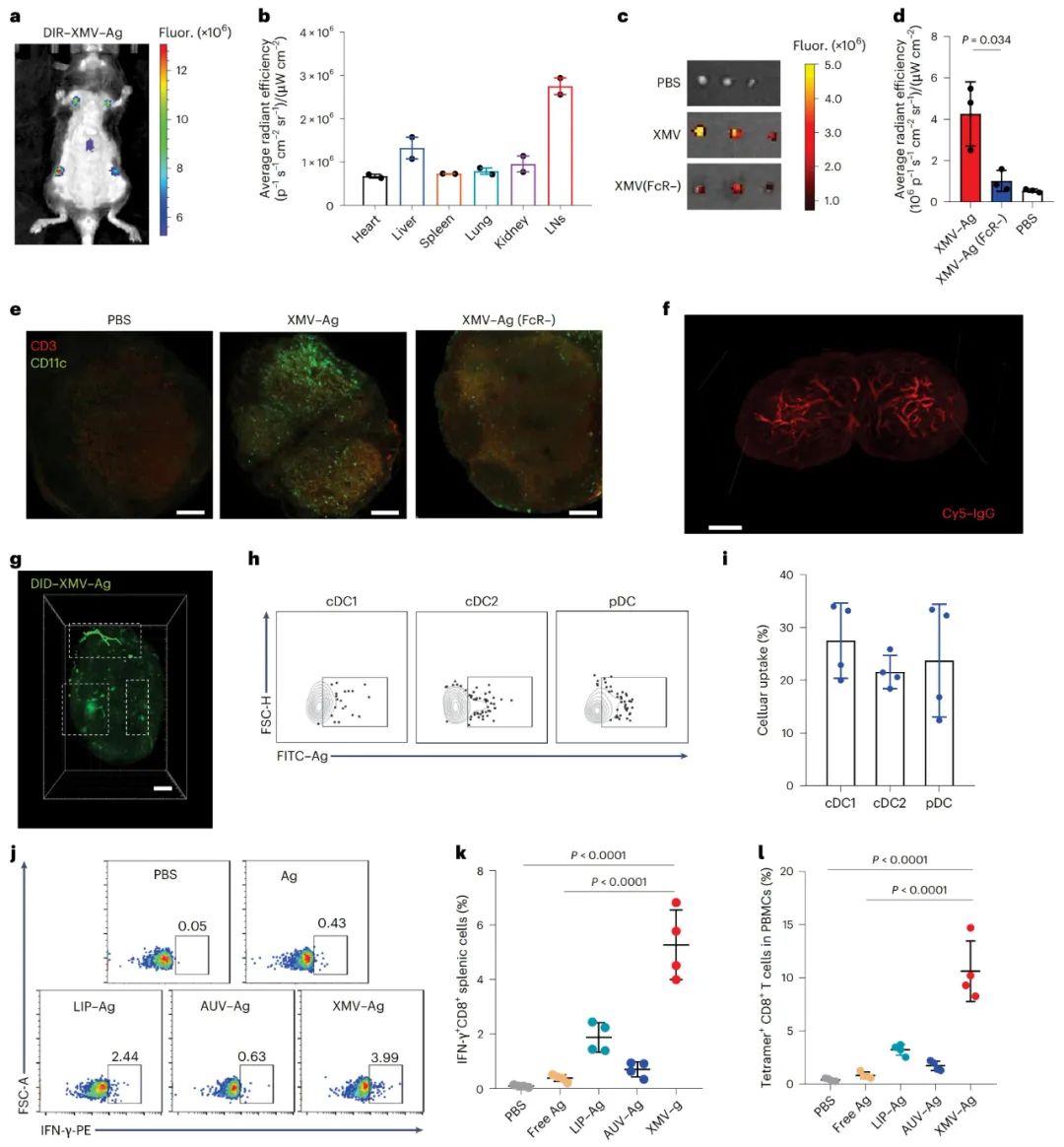
图3 XMVs将抗原特异性递送到淋巴结并诱导强烈的免疫反应
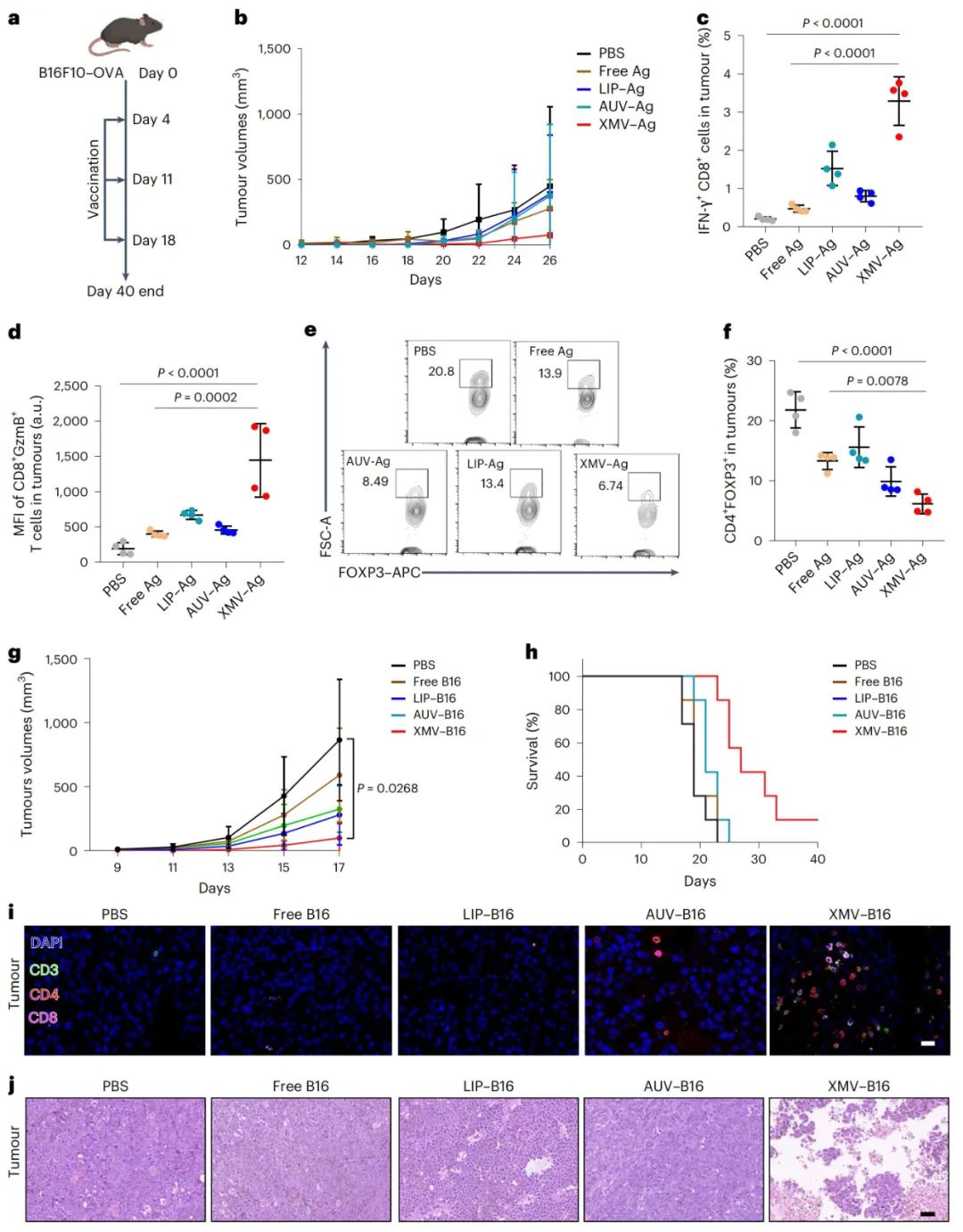
XMVs递送抗原肽抑制体内肿瘤生长
为了给表达卵清蛋白的B16F10-OVA癌细胞构建肿瘤模型,给小鼠接种肿瘤细胞后,分别用XMV-Ag、AUV-Ag、LIP-Ag或Ag进行免疫治疗。监测肿瘤体积发现,XMV-Ag处理显著抑制了B16F10-OVA肿瘤的生长,而其他疫苗制剂的抑制效果有限。
通过流式细胞术检测肿瘤组织中的T细胞浸润情况,发现XMV-Ag处理组小鼠肿瘤浸润的CD8+IFN-γ+T细胞和CD8+GranzymeB+T细胞比例显著增加,同时CD4+FOXP3+调节性T细胞群体减少。
此外,XMV-Ag处理延长了小鼠的生存期,且对小鼠体重无明显影响,主要器官的H&E染色和血液生化分析表明XMV-Ag疫苗具有良好的生物相容性。用XMV封装肿瘤新抗原进行实验,也得到了类似的结果,即XMV递送新抗原能有效抑制肿瘤生长,诱导肿瘤细胞裂解,引发强大的抗肿瘤免疫反应。
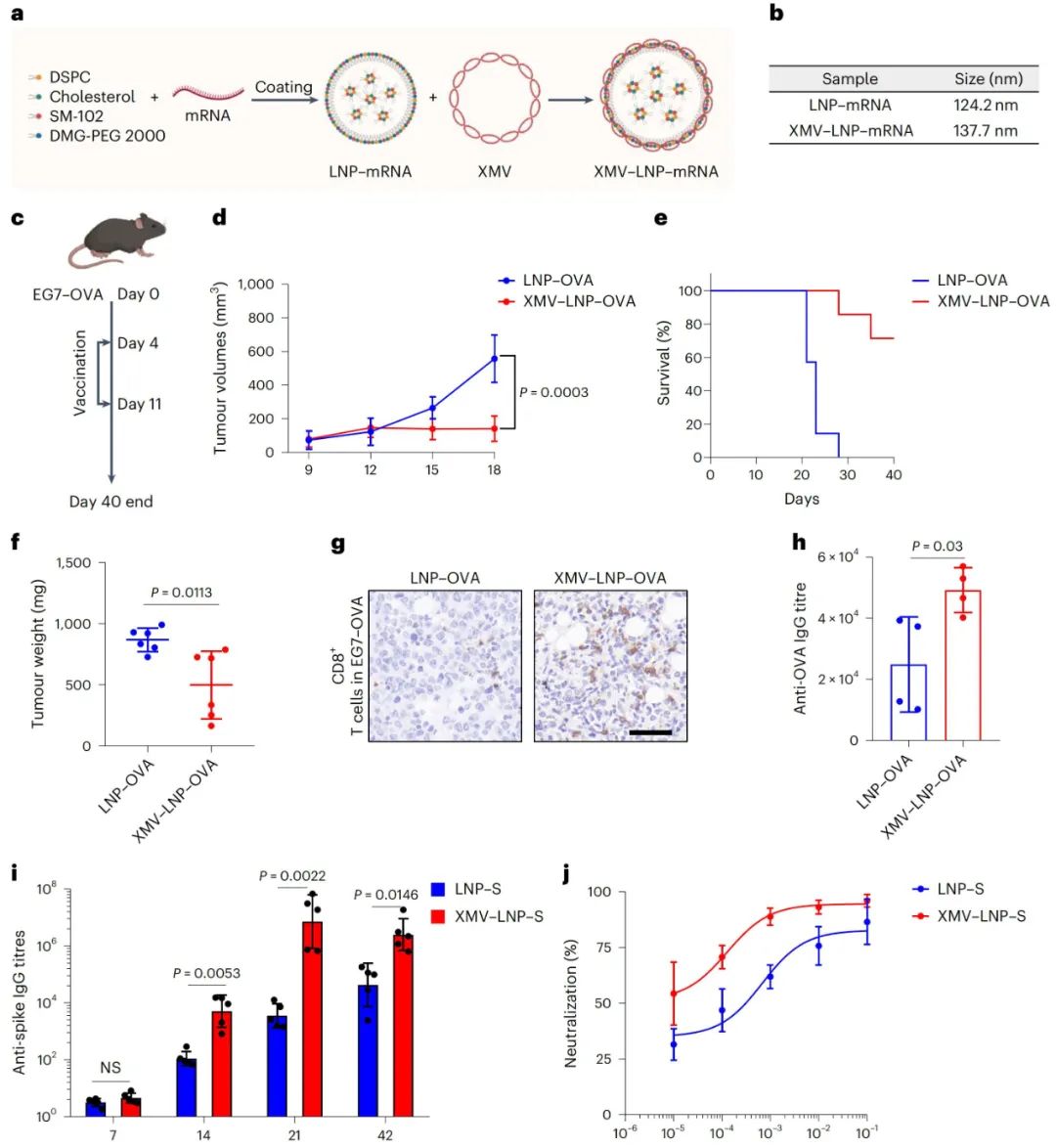
XMV-LNP混合系统用于mRNA疫苗递送
制备XMV包裹在SM-102LNP-mRNA表面的XMV-LNP混合系统,检测发现其流体动力学直径略有增加。给小鼠皮下注射标记的XMV-LNP和SM-102LNP,通过IVIS观察发现,XMV涂层显著增强了LNP在LNs中的积累,减少了在肝脏中的分布。
以表达卵清蛋白的小鼠胸腺瘤EL4细胞(EG7-OVA)构建肿瘤模型,用XMV-LNP-OVA和LNP-OVA进行治疗,结果显示XMV-LNP-OVA能显著抑制肿瘤生长,延长小鼠生存期,提高肿瘤组织中CD8+T细胞浸润和OVA特异性IgG滴度,且H&E染色表明其能诱导更高程度的肿瘤细胞坏死。
在针对SARS-CoV-2的研究中,制备XMV-LNP-S并免疫小鼠,检测发现其诱导产生的抗刺突蛋白受体结合域IgG滴度和SARS-CoV-2中和抗体滴度分别比标准的SM-102疫苗制剂高约32倍和6倍,同时H&E染色证明该疫苗处理后主要器官安全,表明XMV涂层能改善LNP-mRNA疫苗的DC靶向递送,提高疫苗的抗肿瘤和抗病毒免疫效果。
梁兴杰和宫宁强团队的研究确定了异种细胞膜衍生囊泡(XMVs)在疫苗递送中靶向树突状细胞(DCs)的关键作用机制,提出了一种模拟异种移植排斥反应过程进行疫苗递送的新策略。这一策略不仅在靶向性、免疫激活能力和安全性方面展现出显著优势,还为癌症治疗和传染病疫苗开发提供了新的技术平台。
研究证实了XMVs在促进DC激活、抗原交叉呈递以及向淋巴结转运等方面的积极作用。揭示了XMVs在癌症和传染病疫苗应用中的巨大潜力,为开发高效低毒的疫苗递送系统提供了新方向,但动物源生物产品用于人体的安全性风险仍需进一步评估。
云舟生物(VectorBuilder)为该研究提供了COVID-19 S蛋白IVT质粒和CleanCap COVID-19 mRNA,助力构建和制备用于实验的相关疫苗,推动了关于XMV-LNP混合系统在mRNA疫苗递送方面的研究,对评估其在癌症和传染病疫苗应用中的潜力起到了重要作用。
【参考文献】
VectorBuilder云舟生物是世界知名分子生物学家蓝田博士创办的基因递送领军企业,在全球设有10余家子公司和办事处,2023年晋升为全球独角兽企业。
云舟生物独创“载体家”平台,开启了个性化基因载体的商品化时代;目前已赋能全球90多个国家和地区,为超过4500家顶尖科研院校和制药公司提供服务,在QS前100高校的客户覆盖率达到了90%,全球TOP30药企的客户覆盖率亦超过90%,产品成果的全球文献引用量逾5000篇。
云舟生物的基因药物CRO、CDMO项目遍布北美、欧洲、日本等多个国家和地区,已成功助力全球数十个项目成功开展IIT或IND研究,其中GMP级别的质粒和慢病毒载体已获得美国FDA的IND正式批准,用于在美国的多中心临床试验。
云舟生物致力于系统性攻克基因递送行业的关键技术瓶颈,为行业和世界创造不可取代的价值。






- 排行
